1 - Classification
Famille : Picornaviridae
Ces virus appartiennent au groupe des virus ARN positif : |
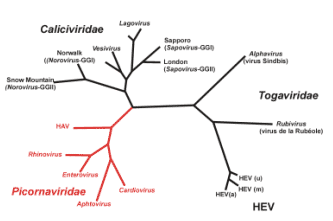 |
9 genres :
Six genres sont pathogènes pour l’homme ;
- Enterovirus
Human enterovirus A [HEV-A], (entérovirus humains A) (12 sérotypes)
Human enterovirus B [HEV-B], (entérovirus humains B) (36 sérotypes)
Human enterovirus C [HEV-C], (entérovirus humains C) (11 sérotypes) + Poliovirus [PV], (3 sérotypes)
Human enterovirus D [HEV-D], (entérovirus humains D) (2 sérotypes)
- Rhinovirus
Human rhinovirus A [HRV-A], (rhinovirus humains A) (58 sérotypes)
Human rhinovirus B [HRV-B], (rhinovirus humains B) (17 sérotypes)
Rhinovirus humains non classés (25 sérotypes)
- Hepatovirus
Hepatitis virus A [HAV], (virus de l'hépatite A) (1 sérotype)
- Parechovirus
Human parechovirus [HPeV], (parechovirus humain) (2 sérotypes) (anciennement entérovirus 22 et 23)
- Cardiovirus
Theilovirus : Vilyuis Human encephalomyelitis [VHEV], (virus de l'encéphalomyélite humaine de Vilyuisk)
->Le virus de l’encéphalomyélite humaine de Vilyuisk est le seul virus du genre Cardiovirus pathogène pour l’homme. Responsable d’une maladie neurologique dégénérative et la zone d’endémie est localisée à la Sibérie.
- Kobuvirus
Aichi virus [AiV], (virus Aichi) (1 sérotype)(pour en savoir plus)
->Le virus Aichi (genre Kobuvirus) serait à l’origine de gastro-entérites virales.
Trois genres Aphtovirus, Erbovirus et Teschovirus ne sont pathogènes que pour les animaux.
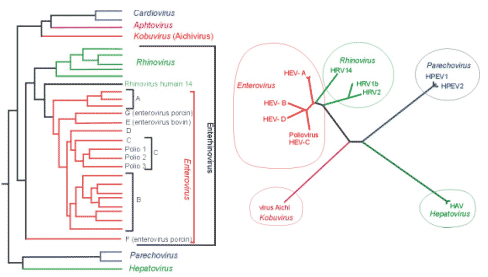
Arbre phylogénétique des virus de la famille Picornaviridae pathogènes chez l'homme.
2. Caractéristiques du virus
. Structure
| Virus non enveloppés. Capside icosaédrique. Taille : 27-30nm. Génome : ARN monocaténaire de polarité positive (Photographie Pr Albert Bosch, Département de Microbiologie, Université de Barcelone, Espagne, avec l'autorisation de l'auteur) |
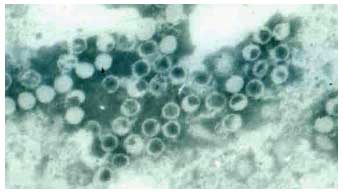 |
. Résistance physico-chimique
- Très résistant : pH acides, l'alcool à 70°, éther, déoxycholate de sodium et détergents. Se conservent quelques semaines dans l’environnement et des années à -20°C.
- Détruits par : oxydants (hypochlorite de soude), formol, bêta-propionolactone et UV.
- Rhinovirus rapidement inactivés à pH 6
· Le génome (pour en savoir plus)
. ARN simple brin de polarité positive comprenant entre 7200 (Rhinovirus humain 14) et 8500 nucléotides (Aphtovirus). L’ARN génomique est infectieux
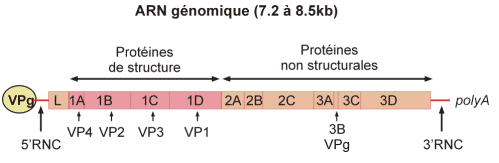
· RNC= région non codante.
- La région 5' non codante (600 – 1200 nucléotides) :
-> est conservée parmi les différents entérovirus (possibilité de diagnostic par PCR pour l'ensemble du genre entérovirus).
-> est importante pour la multiplication virale (traduction et encapsidation) et la virulence.
-> comprend une structure secondaire dénommée internal ribosome entry site (IRES).
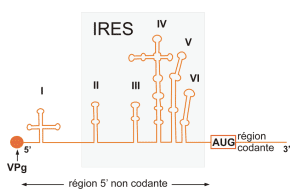
- La région 3’ non codante (50 – 100 nucléotides) est importante pour la synthèse du brin complémentaire (ARN-).
· Le génome code une grande polyprotéine d’environ 2100 – 2400 acides aminés, qui subira un processus de maturation par clivage protéolytique.
· Les deux extrémités du génome sont modifiées par:
-> une liaison covalente à une petite protéine, VPg, à l’extrémité 5’.
-> une polyadénylation à l’extrémité 3’.
· L’organisation du génomique est similaire pour l’ensemble des Picornaviridae.
3. Multiplication (pour en savoir plus)
· Récepteurs
|
Virus
|
Récepteur cellulaire
|
| Rhinovirus (91 sérotypes) Rhinovirus (10 sérotypes) Poliovirus Echovirus 1, 8 Echovirus 22 Echovirus * Coxsackie A Coxsackie B1-B6 Virus de l’hépatite A |
ICAM 1 (Intracellular adhesion molecule) : superfamille des immunoglobulines LDLR (Low density lipoprotein receptor) : récepteur des LDL (lipoprotéines de basse densité) CD155 (PVR poliovirus receptor) : superfamille des immunoglobulines a2b1 integrine (VLA-2): intégrines avb3 integrine (vitronectine receptor) : intégrines CD55 (DAF=decay accelerating protein) ICAM 1 CAR (coxsackievirus-adenovirus receptor) : superfamille des immunoglobulines HAVCr-1 : superfamille des immunoglobulines + mucin-like |
* Echovirus 3, 6, 7, 11-13, 20, 21, 24, 29 et 33 ainsi que les Coxsckievirus A21 et Enterovirus 70
· Attachement, pénétration, décapsidation
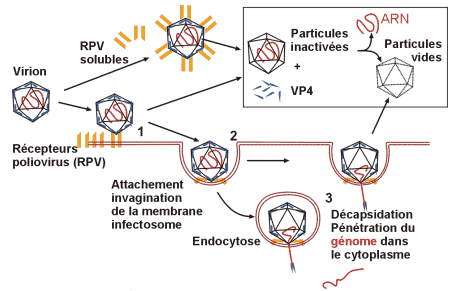
· Réplication du génome
La multiplication des Picornaviridae a lieu en totalité dans le cytoplasme de la cellule.
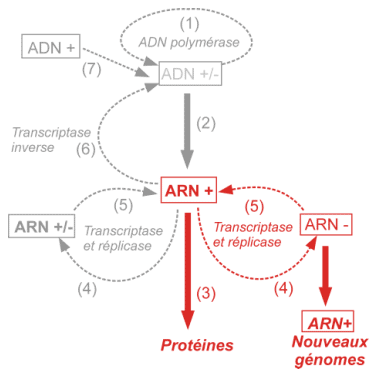
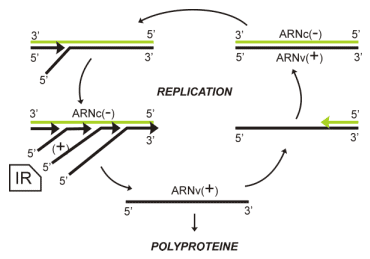
La réplication du génome ARNv(+) par une ARN polymérase nouvellement synthétisée passe par une matrice ARNc(-) et des intermédiaires de réplication (IR).
Les nouveaux génomes ARN(+) pourront être traduits en une polyprotéine, recommencer un cycle de réplication ou être encapsidés dans de nouveaux virions
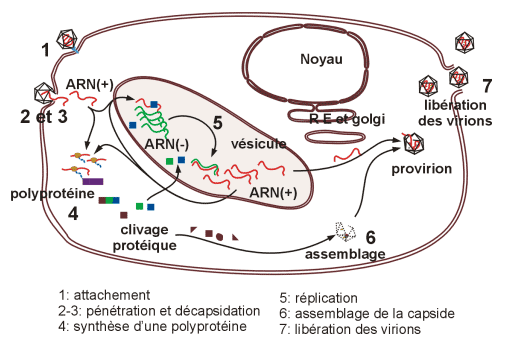
Cycle infectieux complet des Picornaviridae
· Synthèse et maturation protéique
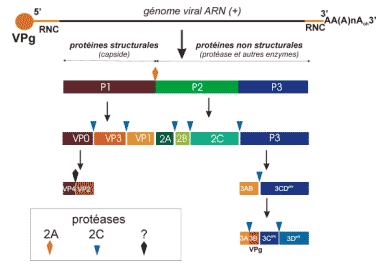
Processus de synthèse de la polyprotéine et des clivages protéolytique de maturation
· Maturation protéique et assemblage des virions
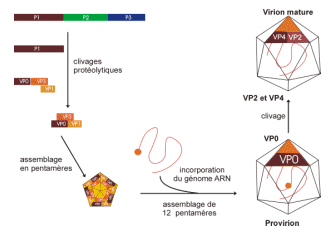
Processus d’assemblage de la capside et encapsidation du génome
4. Pouvoir pathogène
Plusieurs infections souvent inapparentes à Picornaviridae au cours de sa vie.
- Les infections à rhinovirus sont marquées par un tropisme respiratoire
- Les entérovirus par le neurotropisme des poliovirus et de certains entérovirus.
5. Epidémiologie
- Les rhinovirus se transmettent par voie respiratoire.
- Les entérovirus et l’hépatite A se transmettent selon un mode féco-oral.
Picornaviridae : Les Rhinovirus
1. Caractéristiques du virus
Caractères généraux des entérovirus mais deux différences :
- sensibles aux pH acides<6,
- se multiplient à 33°C et non pas à 37°C.
Plus de 111 sérotypes identifiés.
2. Multiplication
In vitro sur cellules humaines de rein ou fibroblastes à 33°C. Effet cytopathogène tardif, entre le 7e et le 22e jour.
3. Pouvoir pathogène
Enfants : réservoir important de virus.
Cible des rhinovirus : épithélium nasal.
Coryza et rhiniteavec parfois hyperréactivité bronchique.
4. Diagnostic virologique
- Le diagnostic direct.
Isolement sur cultures cellulaires à 33°C puis identification par le test à l'acidité (inactivation complète du virus après passage en milieu acide).
Détection et identification par RT-PCR.
- Le diagnostic indirect est sans intérêt
Picornaviridae : Les Enterovirus
Caractères généraux des Picornaviridae avec tropisme pour le tractus digestif et le système nerveux.
1. Caractéristiques des virus
· Propriétés antigéniques
Déterminants antigéniques portés par la capside virale
- Identification des sérotypes par immunsérums neutralisants
- Pas de déterminant antigénique commun à toutes les souches d'entérovirus.
· Poliovirus
Trois sérotypes de poliovirus, sans communauté antigénique, donc un vaccin trivalent.
Différences intratypiques.
Différentiation des souches sauvages et vaccinales possible.
· Entérovirus non poliomyélitiques
On identifie par séroneutralisation 23 coxsackievirus A, 6 coxsackievirus B, 28 echovirus, et 4 entérovirus numérotés 68 à 71.
· Souches non typables
De plus en plus fréquemment (> 10 % des cas) le typage des souches ne permet pas une identification précise des entérovirus.
|
Espèces
|
Sérotypes
|
Classification
|
| Human enterovirus A (Enterovirus humain A) (12 sérotypes) |
coxsackievirus A2-A8 A10, A12, A14, A16 entérovirus 71 |
A |
| Human enterovirus B (Enterovirus humain B) (36 sérotypes) |
coxsackievirus B1-B6 échovirus 1-7, 9, 11-21, 24-27, 29-33 entérovirus 69 |
B |
| Human enterovirus C (Enterovirus humain C) (11 sérotypes) |
coxsackievirus A1, A11, A13, A15, A17-21, A22, A24 |
C |
| Poliovirus (3 sérotypes) |
poliovirus 1-3 |
C |
| Human enterovirus D (Enterovirus humain D) (2 sérotypes) |
Entérovirus 68 et 70 |
D |
Genre Entérovirus. Correspondance entre nouvelle classification et ancienne dénomination.
· Propriétés génétiques
Quatre groupes A, B, C et D.
Diagnostic par PCR (séquences conservées entre entérovirus humains).
2. Multiplication
Multiplication in vitro à l'échelle cellulaire : effet cytopathique caractéristique.
3. Epidémiologie
Réservoir : humain.
Transmission :
· féco-orale surtout,
· parfois aérienne :
coxsackie A21 : infections respiratoires ; entérovirus 70 : conjonctivites hémorragiques.
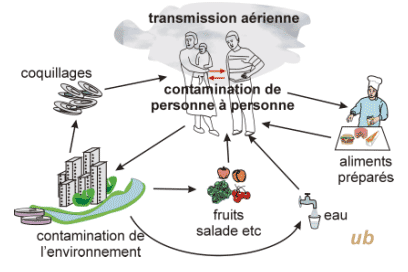
Zone de diffusion
· Epidémiologie des entérovirus non poliomyélitiques
Dans les pays tempérés épidémies à échovirus et coxsackievirus.
Dans les pays à bas niveau sanitaire, infections endémiques.
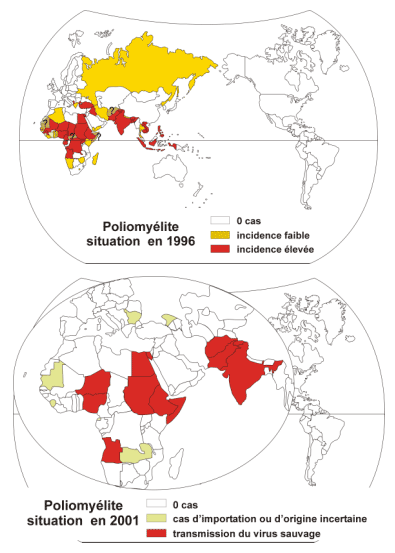
· Epidémiologie des poliovirus
Evolution de la situation de 1996 à 2001
4. Pouvoir pathogène
· 4.1 Physiopathologie
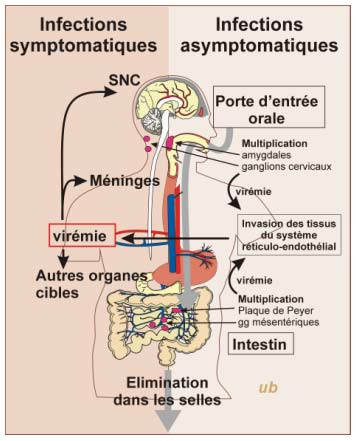
Physiopathologie des infections à entérovirus
· 4.2 Pouvoir pathogène chez l'homme
4.2.1 Pathologies dues aux entérovirus autres que les poliovirus
Les infections à entérovirus sont souvent asymptomatiques.
Cependant, les entérovirus sont aussi responsables d’une pathologie variée, souvent non spécifique.
Les manifestations neurologiques
- Méningite lymphocytaire de l'enfant et de l’adulte
Les entérovirus sont l’étiologie la plus fréquente (80%-95%) des méningites lymphocytaires. De nombreux sérotypes sont impliqués (échovirus 3, 4, 6, 7, 9, 11, 16 et 30 ; coxsackievirus A7, A9, B 1-6 ; entérovirus 71 pour les plus fréquents)
Ces méningites lymphocytaires à entérovirus surviennent principalement en été et à l’automne.
En règle générale elles régressent sans séquelle.
- Encéphalite à entérovirus est plus rares, elle peut compliquer un tableau de méningite.
- Paralysie flasque isolée (entérovirus 70 et 71, coxsackievirus A7).
Les manifestations cardiaques et musculaires
- Myocardite et péricardite (principalement coxsackievirus B1-B5). Les entérovirus sont également à l’origine de cardiomyopathie chronique.
- Pleurodynie ou maladie de Bornholm (B1-B5) = douleur thoracique voire abdominale d'apparition brutale.
Les manifestations cutanées et muqueuses
- Herpangine : coxsackievirus A (pour en savoir plus).
- Syndrome main-pied-bouche : coxsackie A9, A16 (pour en savoir plus).
- Eruptions cutanées : surtout echovirus 9.
- Exanthème de Boston (echovirus 16)
- Conjonctivites hémorragiques (entérovirus 70, coxsackievirus A24)
Les rhinopharyngites et infections respiratoires
- Coryza (nombreux sérotypes),
- Bronchiolites (entérovirus 68).
Les infections néonatales
- Fièvre, voire tableau de septicémie avec atteinte poly-viscérale
Les autres pathologies
- Diabète juvénile ? (coxsackievirus B4)
- Pathologies musculaires chroniques ? Syndrome de fatigue chronique ?
4.2.2 La poliomyélite antérieure aiguë
(Voir BEH sur la poliomyélite http://www.invs.sante.fr/beh/2000/004647/index.html)
(voir aussi émergence et éradication de la poliomyélite)(pour en savoir plus)
- Les infections à poliovirus sont le plus souvent limitées (« poliomyélite abortive ») : fièvre avec symptomatologie intestinale, plus rarement méningite.
- La forme paralytique est l’expression la plus grave de l'infection. Après une incubation de 4 à 10 jours des paralysies flasques apparaissent précédées de prodromes à type de troubles sensitifs, douleurs. L’importance des paralysies est variable.
- L’évolution est partiellement régressive.
- Les séquelles fonctionnelles importantes : amyotrophie, atrophie d’un membre
Le diagnostic de poliomyélite antérieure aiguë est une urgence, tant pour le patient que pour l’entourage.

En France, la poliomyélite a disparu en 1990. Afin d’éviter une reprise de la circulation des poliovirus sauvages à partir d’une importation, le signalement des cas doit être fait au stade de suspicion du diagnostic afin de permettre une identification précoce des virus.
5. Diagnostic virologique
5.1 Contexte du diagnostic
Les sites de multiplication sont principalement situés au niveau des voies digestives et respiratoires. Ainsi, l’isolement d’un entérovirus de ces sites « non stériles » ne représente pas une preuve formelle de sa responsabilité dans l’origine de la maladie. L’isolement à partir du LCR, de la conjonctive, de liquide vésiculaire ou amniotique a une valeur diagnostic indiscutable.
Les infections à entérovirus sont courantes, souvent asymptomatiques ou sans caractères pathognomoniques. Le prélèvement peut de ce fait être trop tardif et réduire les chances de détecter le virus.
5.2 Diagnostic direct
- les prélèvements
Effectués au début des signes cliniques au niveau des selles, de la gorge, LCR, lésions cutanéomuqueuses, conjonctives et liquide amniotique.
- l'isolement des entérovirus sur cultures cellulaires
Technique de référence par sa sensibilité. Cependant elle nécessite l'ensemencement de plusieurs lignées cellulaire et certains virus ne cultivent pas (coxsackievirus A notamment).
Le diagnostic est orienté par l’effet cytopathique ; il est confirmé par un anticorps monoclonal reconnaissant la plupart des entérovirus.
- L’identification du sérotype viral est réalisée par séroneutralisation à l’aide de pool d’antisérums (pools de Lim, Benyesh-Melnick).
- la détection du génome des entérovirus par RT-PCR
Elle utilise des amorces hybridant des régions conservées de l’extrémité 5’ non codante. Elle n’est pas plus performante que la culture sauf pour la détection des entérovirus dans le LCR. Mais elle est beaucoup facile d’utilisation que la culture sur cellules.
- L'isolement d'un poliovirus doit entraîner une déclaration aux autorités sanitaires, la confirmation du diagnostic et la caractérisation de la souche par un Centre de Référence.
·5.3 Diagnostic indirect
Dans le cadre d'une infection aiguë, le titrage des anticorps dans une réaction de neutralisation n'a d'intérêt que si l'on a isolé un entérovirus chez le patient.
5.4 Principales indications
· affection neuroméningée aiguë
· infection maternofoatale ou néonatale
· myocardite/péricardite aiguë
· fièvre éruptive chez la femme enceinte (diagnostic différentiel avec la rubéole)
· paralysie flasque aiguë (voir supra).
· infection chez l’immunodéprimé (prélèvements multiples).
6. Traitement et prévention
Aucun traitement antiviral efficace.
Prévention : la vaccination antipoliomyélitique.
- Vaccin inactivé (vaccin Salk)
Contient les trois sérotypes de poliovirus, inactivé par la bêta-propiolactone.
Innocuité absolue.
N’empêche pas l’implantation d’un virus sauvage.
- Vaccin vivant atténué (vaccin Sabin)
Contient des souches de poliovirus type 1, 2, 3 ayant perdu leur neurovirulence.
N’est plus utilisé sauf en cas d’épidémie.
- Recommandations du calendrier vaccinal 2000 en France
- A l'âge de deux mois, trois mois, quatre mois : le vaccin polio injectable est recommandé pour les primo vaccinations.
- Rappel à 18 mois, 6 ans, 11 ans, 18 ans.
- Rappel de vaccin polio injectable tous les 10 ans, associé à la vaccination antitétanique.
- Le vaccin polio oral est réservé aux situations épidémiques.
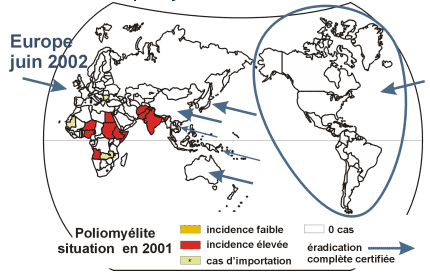
Eradication du virus de la poliomyélite : situation en 2002 (pour en savoir plus)
Ce cours a été préparé par le Pr. Pierre Pothier (Laboratoire de Virologie, Université de Bourgogne et CHU de Dijon).
Pour en savoir plus : « Virologie médicale » A. Mammette, Collection AZAY, Presses Universitaires de Lyon. 2002, 80 Boulevard de la Croix Rousse, BP 4371, 69242 LYON 04
|
|
|
|
|
