FRANCISELLA


La tularémie appelée aussi maladie de Francis, fièvre de la mouche du daim, maladie de Ohara, Yato-Byo, fièvre de la vallée de Pahvant est une zoonose, mal connue, qui peut être grave. Cette maladie est en relation avec une bactérie, Francisella tularensis qui sévit dans diverses régions du monde, plus particulièrement dans l’hémisphère Nord. En France, découverte en 1946, mais suspectée depuis 1932, elle existe, le plus souvent, sous forme de cas sporadiques aussi bien chez l’homme que l'animal, mais des cas groupés peuvent se manifester. La maladie a pris une plus grande importance depuis les événements de septembre et octobre 2001 aux États-Unis, son agent fait partie de ceux potentiellement utilisables comme arme biologique étant donné son caractère dangereux et virulent (agent biologique de la classe 3 pour F. tularensis subsp. tularensis). En revanche, F. tularensis subsp. holartica, la seule isolée en France appartient à la classe 2.
http://www.tdh.state.tx.us/bioterrorism/facts/tularemia.html
http://www.uhmc.sunysb.edu/microbiology/bioterrorism.htm
http://veille-srv.inist.fr/~Synthese_Bioterrorisme/Dossier/dossier.html
- Historique
|
Cette maladie et son agent F. tularensis ont été étudiés de 1911 à 1924 par Mac Coy, Chapin, Lamb, Francis, Parker et Spencer en Californie dans le comté de Tulare. Ils ont montré que l’affection qui sévissait chez les écureuils et les lapins sous la dénomination de « pseudo-peste des rongeurs » ou encore le daim était la même qui sévissait chez l’homme sous des dénominations diverses « fièvre de la mouche du cerf ou deer fly fever", que son agent était identique et que certains vecteurs pouvaient jouer un rôle dans la transmission de la maladie. |
 |
|
|
E. Francis (à gauche) démontra la transmission chez l'animal par la "mouche du cerf" et proposa le terme de "tularémie" pour diverses maladies animales: "deer fly fever", "cattle fly fever, "rabbit fever" et "tick fever". À partir de 1920, la maladie est identifiée au Japon par Ohara (à droite), où elle aurait été décrite dès 1820 par Homma. Peu à peu, elle est mise en évidence sur le continent eurasien, en Russie dès 1921, puis en Suède en 1932, en Norvège, en Finlande, en Italie, en Turquie (1935), en basse Autriche, en Hongrie, en Tchécoslovaquie, en Moravie, en Slovaquie, en Allemagne, enfin en Grèce en 1939. |
- En France, la tularémie est diagnostiquée en 1946–1947 dans l'Allier, le Gers, la Gironde, puis en Franche-Comté-Côte-d’Or, en Lorraine.........mais plusieurs cas suspects sont décrits dès 1930–1932 chez l’homme.
Depuis, cette affection est régulièrement mise en évidence, chaque année, aussi bien chez l’animal que chez l’homme, de façon le plus souvent sporadique. Si les cas humains se retrouvent en majorité dans les zones d’endémie de la maladie animale, un certain nombre survient dans des régions endémiques et sans contact apparent avec des animaux.
Synonymes: Francis disease, rabbit fever, deer fly fever.
- Caractéristiques bactériologiques - Taxonomie
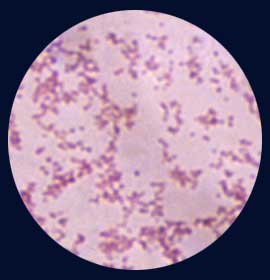
- F. tularensis est un minuscule coccobacille à Gram-négatif. Cette bactérie intracellulaire, est entourée d’une capsule pour les formes virulentes. Sa disparition entraine la perte de virulence chez l'homme.
Les lipides de la paroi et ceux de la capsule sont pour une bactérie à Gram-négatif, en proportions inhabituelles (70 et 50 %), la nature des acides gras étant particulière au genre Francisella.
- Cette bactérie a connu diverses appellations: Bacterium tularense, Pasteurella tularensis, Brucella tularensis par les microbiologistes soviétiques, Francisella tularense et enfin F. tularensis en hommage rendu à Francis, et à sa première localisation dans le comté de Tulare en Californie. Après avoir été rangé dans le genre Pasteurella, le genre Francisella a une position taxonomique suivante: appartient au Gamma-Proteobacteria, à l'ordre des Thiotrichales et à la famille des Francisellaceae avec le genre Francisella.
Après les travaux d’Olfsujev et al., de Jellison et al., d’Aikimbaev et d’Olfsujev et Meschcheryakova en 1983, plusieurs sous-espèces de F. tularensis sont maintenant validées:
| F. tularensis subsp. tularensis (ancien biovar tularensis, ancien type A) |
| F. tularensis subsp. holarctica (ancien biovar holarctica, ou encore palearctica, ancien type B) |
| F. tularensis subsp. mediasiatica |
* F. tularensis subsp. tularensis est la plus virulente des espèces, rencontrée essentiellement en Amérique du Nord et particulièrement aux États-Unis. Elle a été récemment trouvée en Europe, en 1998, sur des tiques en Slovaquie dans la région de Bratislava. Un petit nombre de bactéries (10 à 50) est capable par voie respiratoire ou par voie cutanée de provoquer une maladie sévère chez l’homme avec un taux de létalité voisin de 10 % en l’absence de traitement antibiotique spécifique, qui peut être abaissé à 1 % si le traitement est fait rapidement. La pathogénicité de cette sous-espèce en fait un agent de guerre bactériologique par les formes cliniques et l’évolution de la maladie qu’elle détermine.
** F. tularensis subsp. holarctica est moins pathogène, était jusqu'en 1998, la seule rencontrée en Europe, elle co-habite dans le Nord des États-Unis et au Canada avec F. tularensis subsp. tularensis. Elle peut provoquer une maladie identique à celle induite par la précédente sous-espèce mais moins grave. Ainsi le taux de létalité est de 1 % en l’absence de traitement et qui s’abaisse à 0,1 % si un traitement est rapidement prescrit. Cette sous-espèce comporte trois biotypes :
|
Biotype I
|
érythromycine S glucose + maltose + glycérol – citrulline–uréidase –
|
|
Biotype II
|
érythromycine R glucose + maltose + glycérol – citrulline–uréidase –
|
|
Biotype III
(biovar japonica) |
érythromycine S glucose + maltose + glycérol + citrulline-uréidase -
|
*** F. tularensis subsp. mediasiatica sévit en Asie et est comparable à F. tularensis subsp. holarctica pour sa virulence.
- Enfin en 1989, à la suite de travaux portant sur les caractères biochimiques, la composition des acides gras et les homologies ADN - ADN, Hollis et coll. transfèrent Yersinia philomiragia dans le genre Francisella avec la dénomination de Francisella philomiragia.
http://www.bacterio.cict.fr/bacdico/ff/francisella.html
http://www.bacterio.cict.fr/bacdico/ff/tphilomiragia.html
- Le génome de cette bactérie est connu pour une seule souche (F. tularensis subsp. tularensis souche militarisée Schu4) depuis peu de temps (2004). Celui-ci est petit (1,89 Mbp) pour un GC% de 32 : http://veille-srv.inist.fr/~Spip_Biodefense/article.php3?id_article=101
http://www.ncbi.nlm.nih.gov/genomes/lproks.cgi?view=1
- Habitat
* Il s'agit essentiellement d'une zoonose et on peut répartir les espèces animales (190 connues) dont les mammifères en trois groupes selon leur sensibilité, les espèces les plus réceptives étant les rongeurs (campagnol, écureuil, castor, rat musqué, lemming, ragondin, souris, cobayes) et les lagomorphes (lièvres, éventuellement lapin de garenne). Des animaux peuvent être porteurs sains ou faire des formes inapparentes (mammifères tels carnivores domestiques et sauvages, sanglier et oiseaux sauvages). Il ne faut pas omettre les arthropodes.
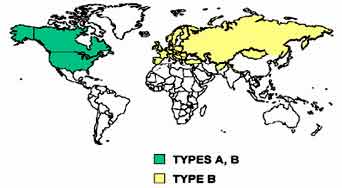
| La tularémie se rencontre principalement dans les zones boisées de l'hémisphère Nord: États-Unis d'Amérique, Europe du Nord avec la Suède, la Finlande……, la Russie et enfin le Japon. Elle est inconnue en Grande Bretagne. Le seul pays de l'hémisphère sud où elle serait présente est le Vénézuela. Sa présence a été suspectée en Afrique. F. tularensis biovar tularensis (type A très virulent), est présente essentiellement aux États-Unis. F. tularensis biovar palearctica ou holarctica (type B, moins virulent) est présente en Europe et en Asie. http://bbrp.llnl.gov:80/bbrp/html |
 |
D'autres espèces ou sous-espèces ont été exceptionnellement rapportées chez l'homme : F. philomiragia et F. tularensis biovar novicida. F. tularensis biovar mediasiatica est présente en Asie.
- Epidémiologie
En France, 435 foyers, essentiellement chez le lièvre, ont été répertoriés en santé animale depuis un peu plus d’une dizaine d’années. Ces foyers ont été détectés avec le concours de certaines fédérations de chasseurs, des agents de l’ONCFS (Office National de la Chasse et de la faune sauvage) qui effectuent le ramassage des lièvres et autres animaux de la faune sauvage morts sur le territoire des communes en France. Ils sont analysés par les laboratoires d’analyses vétérinaires départementaux adhérant au réseau SAGIR (surveillance sanitaire de la faune sauvage) qui dépend de l’ONCFS. L’AFSSA du site de Nancy, rassemble et fait la synthèse de l’ensemble des résultats ayant trait aux maladies du gibier dont les doubles lui sont envoyés par les différents laboratoires d’analyses vétérinaires départementaux.
http://www.vet-lyon.fr/ens/faune/Fiches/Syntheses/tularemie_synth.htm
http://www.oncfs.gouv.fr/events/point_faune/suivi-sanitaire/2003/tularemie.php
www.afssa.fr/ftp/afssa/basedoc/BE%20n6%20.pdf
Evolution de la tularémie animale en France (1999-2004)
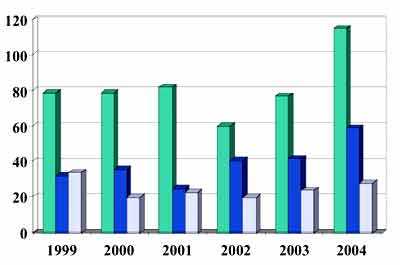 |
Total des prélèvements étudiés
Nombre de souches isolées Nombre de départements positifs |
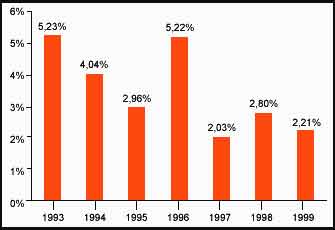
Fréquence de positivité chez le lièvre (1993-1999)
Distribution des foyers de tularémie animale entre 1993 et 2004
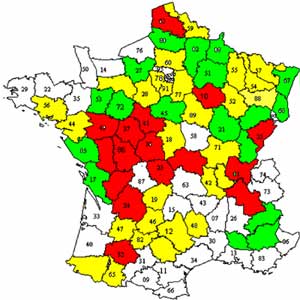

- La tularémie a été diagnostiquée dans 47 départements différents et dans plus de 400 communes en France de 1993 à 2004. Elle semble absente de la Corse et n'ai pas couramment isolée dans les régions Provence-Côte d'Azur Languedoc. Chaque année, il y a ré-émergence possible de la maladie. D'autres espèces animales autres que le lièvre sont atteintes ou porteuses de l'agent tels les rongeurs (campagnols, rats d’eau, écureuils, ragondins...), les lagomorphes tels que les lapins de garenne qui semblent peu sensibles à la maladie, mais qui peuvent excréter le germe. Enfin les carnivores sauvages et domestiques, également peu sensibles, peuvent être porteurs, le plus souvent passifs et peuvent transmettre la maladie à l’homme de façon plus ou moins active (morsure, griffade ou lors de dépeçage). Le sanglier est aussi impliqué. Des cas ont été rapportés chez les primates et les oiseaux de la faune sauvage qui peuvent être atteints.

- Les régions les plus touchées sont les zones humides tels lacs, étangs, marais ou rivières (90 % des cas), bocage et bois où la petite faune trouve des conditions idéales d’habitat et de multiplication ainsi que des vecteurs. Le cycle aquatique de la maladie qui ferait intervenir aussi protozoaires, crustacés, amphibiens, reptiles et divers mammifères est, par ailleurs, fort mal connu. Ce sont, en général, des zones giboyeuses et touristiques qui offrent des possibilités de loisirs (qui se sont développées pour l’homme), mais aussi des facteurs de risques supplémentaires de contamination, particulièrement, ces dernières années, en raison d’une prolifération de la faune sauvage, et des vecteurs. En effet, si la maladie peut se transmettre par voie cutanée ou respiratoire, par contact, léchage, griffure, morsure, ou par inhalation d’aérosols autour d’un animal atteint ou contaminé transitoirement, elle peut se transmettre aussi par piqûre d’arthropodes, particulièrement les tiques, les tabanidés (taons) ou les stomoxynés (mouches piqueuses).
- Ce mode de contamination de l’homme se rencontre surtout de la fin du printemps jusqu’en hiver dans les bois, d'abord les chasseurs mais aussi chez les promeneurs, randonneurs, cueilleurs de baies diverses, de champignons, n'ayant pas pris des mesures de protection adéquates. Ce retour à la nature de l’homme et le besoin de vivre à son contact ont favorisé des attitudes à risque, promiscuité avec des animaux de la faune sauvage qui deviennent familiers et qui envahissent les abords des habitations, les jardins, les potagers, les tas de bois, les mares, voire les piscines, les parcs, les remises et les abris où ils y trouvent nourriture, abreuvement, gîtes, et peuvent contaminer l’environnement s’ils sont malades ou porteurs–excréteurs. En dehors des périodes légales de cette dernière, le braconnage se pratique assez régulièrement par un certain nombre de personnes et c’est un facteur de risque supplémentaire de contamination qui sera difficilement évoqué par la suite.
On n'oubliera pas certaines professions plus exposées comme les vétérinaires, les garde chasses ou encore les techniciens des laboratoires départementaux.
Réservoirs et vecteurs selon le continent
Europe :
. Europe Centrale et Ouest : lièvre d'Europe, campagnol, rat musqué, rat d'eau, ragongin écureuil, et tiques (Ixodes ricinus, Rhipicephalus sanguineus) et aussi moustiques.
. Europe du Nord : lièvre variable, écureuils, lemmings et autres petits rongeurs.
Les moustiques sont aussi une source de contamination chez l'homme parmi d'autres vecteurs (taon.....).
Amérique du Nord:
. Etats-Unis, F. tularensis biogroupe tularensis est responsable de 70% des cas humains. Les tiques sont la principale source de l'infection en été, particulièrement dans les Etats du centre. Les mammifères les plus atteints sont les lapins, les lièvres, les campagnols, les chiens de prairie ou encore les moutons.
. Nord des Etats Unis - Canada : F. tularensis palearctica peut être trouvée et circule surtout dans le cycle aquatique et atteint les mammifères suivants : rat musqué principalement, castor et orignaux.......
Ex-Union Soviétique : Les petits rongeurs sauvages et le lièvre constituent des sources de contamination directe de l'homme en hiver. Les moustiques représentent la source dominante en automne.
Pour plus d'informations: http://www.oie.int/fr/maladies/fr_mal.htm
- Pouvoir pathogène
- En France, il s'agit essentiellement d'une maladie animale, en particulier du lièvre mais aussi des petits rongeurs tels mulot, campagnol, rat musqué, ragondin, écureuil........
 |
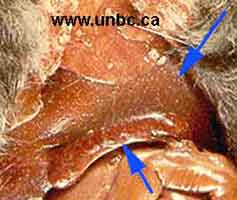
- La maladie évolue, le plus souvent, sous la forme aiguë septicémique en 1 à 3 jours et se termine par la mort, sans lésions apparentes à l’autopsie si ce n’est une congestion généralisée des viscères et de la carcasse. - La maladie peut évoluer de façon subaiguë, suivant la virulence de la souche, pendant 3 à 8 jours et se terminer par une septicémie mortelle. A l'autopsie, les lésions visibles se situent sur le foie montrant de petits foyers de nécrose et une splénomégalie pathognomonique ("rate en cigare" du lièvre en haut ; rate normale en bas). |
http://www.unbc.ca/nlui/wildlife_diseases_bc/tularemia.htm
http://www.fapaq.gouv.qc.ca/fr/faune/reg_tar/tularemie.htm
- Certaines espèces moins sensibles comme le lapin de garenne, les carnivores domestiques et sauvages ou encore les suidés (sangliers...) font une bactériémie transitoire avec des troubles généraux fugaces. Bien que guéris, ils peuvent être excréteurs de la bactérie. Attention aux NAC (Nouveaux animaux de Compagnie) : cobaye, furet, hamster, rat, reptile.
- Cette zoonose est donc transmise à l'homme d'abord des léporidés infectés dont le lièvre (80% des observations). Maladie à déclaration obligatoire (depuis 2002), elle est aussi reconnue comme maladie professionnelle dans le cadre du régime agricole (N°7)(gardes forestiers, bouchers, charcutiers, éleveurs, vétérinaires, ou encore technicien/ne). Il s'agira, le plus souvent, d'un cas sporadique, les facteurs de risque étant les promenades en forêt, la chasse et toute activité pouvant mettre en contact l'homme et le réservoir. Une épidémie de 15 cas pulmonaires a été récemment observée en Vendée en 2004 (sur Google®: tapez tularémie et Vendée)
- En France, le nombre de cas annuel est faible: 18 à 72 cas entre 1987-1991. Il s’agit habituellement de formes ulcéro-ganglionnaires par contact soit avec des rongeurs, soit, le plus souvent, avec des lièvres.
- La bactérie est fragile et disparaît en quelques jours d’un cadavre d’animal à des températures supérieures à 0°C. En revanche, elle peut persister plusieurs semaines ou mois à 0°C ou congelée. Elle ne supporte pas la compétition avec les germes de la putréfaction : Proteus, Pseudomonas, Escherichia coli ou encore bactéries anaérobies, d’où la difficulté de poser un diagnostic de certitude sur des prélèvements d’animaux morts ou de l'environnement.
- La transmission directe prédomine avec des voies de pénétration très variées:
- pénétration percutanée: F. tularensis est capable de franchir la peau mais pénètre également par piqûre d'arthropodes hématophages (moustique en Suède et tique ailleurs, Europe, Etats-Unis, Japon).
- pénétration par griffure, morsure, léchage.......
- pénétration conjonctivale: pénétration oculaire (frottement par main souillée, aérosol) ou oro-nasale (main souillée).
- pénétration orale: consommation de viande d'animaux infectés mais insuffisamment cuite, risque par l'eau contaminée.
- contamination par inhalation: aérosols produits dans les laboratoires lors d'autopsie de cadavres tel que le lièvre, ou les changement de litières etc... Les aérosols générés par des machines peuvent provenir de poussières de fourrage, de céréales, de laines souillées par excrétion de rongeurs ou encore certains types de tondeuses ou les souffleurs mécaniques servant à ramasser les feuilles. Cette forme sera privilégiée lors de bioterrorisme.
Les formes cliniques observées sont indiquées ci-dessous :

http://www.invs.sante.fr/publications/guides_biotox/guide_tularemie.html)
http://www.eurosurveillance.org/em/v09n12/0912-234.asp
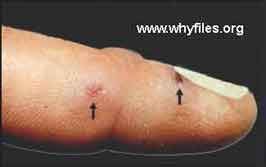
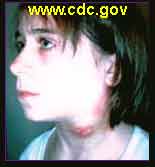
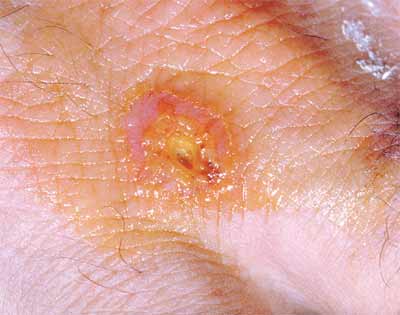
1/ Tularémie ulcéro-ganglionnaire: C’est la forme dite la plus fréquente, elle représente environ 80% des cas de tularémie. Une lésion se forme au point d’inoculation de l’agent, suite à une égratignure, une érosion cutanée minime ou à une piqûre de vecteur, et donne une ulcération. À partir de cette lésion, la bactérie gagne, par voie lymphatique, le ganglion qui draine le territoire et s’y multiplie. Une adénopathie régionale apparaît avec évolution vers une abcédation, fistulisation et sclérose.
* De façon pathognomonique, la lésion primaire qui était en voie apparente de guérison se réactive lors de l'apparition de l'adénopathie.
Exemples d'une forme cutanée et de formes ulcéro-ganglionnaires
- Si le contact a été avec des animaux : lagomorphes (lièvres, lapins de garenne), rongeurs (campagnols, ragondins...), suidés sauvages (sanglier), carnivores domestiques : chien (léchage), chat (griffure), autres mammifères ou éventuellement avec des oiseaux sauvages, la lésion est très souvent à la main ou à un doigt et l'adénopathie axillaire. Le contact peut se faire aussi par l’intermédiaire des excrétas (urines, excréments) des animaux malades ou porteurs sains dans les endroits qu’ils fréquentent : bordures de ruisseaux ou rivières, forêts, tas de bois.
S’il s’agit de piqûre de tiques, l’ulcère est trouvé aux membres inférieurs (jambe) dans 50% des cas, au tronc dans 30% des cas ou à la tête dans 5 à 10 % des cas.
Des plaques d’érythème (tularémides) peuvent apparaître au niveau de l’ulcère ou ailleurs sur le corps.
2/ Tularémie ganglionnaire: Cette forme est similaire à la forme ulcéro-ganglionnaire, sans la lésion cutanée. La bactérie a pénétré à travers la peau saine ou à la faveur d’une abrasion inapparente et a suivi la voie lymphatique ou sanguine.
3/ Tularémie oculo-ganglionnaire: Cette forme se développe souvent après le frottement des paupières avec des mains contaminées, plus rarement après projection de matériel contaminé. La lésion est souvent unilatérale et touche majoritairement la paupière inférieure avec formation d’un petit nodule ou d’une lésion ulcéreuse.Ainsi la tularémie est une des étiologies du syndrome de Parinaud. Une conjonctivite purulente, douloureuse peut se déclarer avec, quelquefois, un œdème périorbital et une adénopathie satellite. Les cas sont rares, moins de 5 % des formes.
4/ Tularémie oropharyngée: Cette forme est assez rare, mais peut se constater lors de l’ingestion de viande d’un animal malade insuffisamment cuite ou lors de l’ingestion de végétaux crus contaminés par de l’urine ou des excréments d’animaux malades et insuffisamment ou non lavés. On observe une angine, qui s’accompagne souvent d’une sensation de brûlures et/ou d’érosions de la muqueuse buccale avec apparition d’adénopathies cervicales. Elle peut parfois se compliquer de douleurs abdominales (adénopathies mésentériques), de nausées, vomissements, diarrhée qui peut, quelquefois, être hémorragique due à des ulcérations intestinales.
5/ Tularémie pulmonaire ou pleuro-pulmonaire: Cette forme primaire rare ne se constate que lors de l’inhalation d’un aérosol de bactéries, peu de bactéries sont nécessaires pour provoquer la maladie : de 10 -20 UFC (F. tularensis subsp. tularensis) à 100 - 1000 UFC (F. tularensis subsp. holarctica). Elle est peut-être plus fréquente, mais sous-diagnostiquée, car bien souvent on n’y pense pas, parce que ces symptômes d’allure grippale peuvent se confondre avec d’autres syndromes.
Dans les conditions naturelles, la notion de rapport avec des animaux de la faune sauvage dans leur environnement doit permettre d’orienter la suspicion et le diagnostic. Elle peut se manifester chez les vétérinaires, les garde-chasses, les travailleurs agricoles, les forestiers, le personnel des laboratoires vétérinaires départementaux, les chasseurs, mais aussi chez des promeneurs en forêt, dans les parcs ou au bord de l’eau, chez des propriétaires de carnivores domestiques à la campagne ou de NAC qui vivent en étroite promiscuité avec leurs animaux. Une toux sèche, de la dyspnée, et des douleurs thoraciques (pleurésie) peuvent être observées. L’examen radiographique peut montrer des îlots de pneumonie dans un ou plusieurs lobes. Une pneumonie franche peut se déclarer uni ou bilatérale avec de façon caractéristique des adénopathies hilaires.Une détresse respiratoire peut s’installer. Cette forme qui peut être grave, fait de la bactérie un agent de bioterrorisme de premier plan. Des formes pulmonaires peuvent être secondaires à des formes ulcéroganglionnaires dans 10 à 15 % des cas et à des formes typhoïdiques dans 30 à 70 % des cas.
6/ Tularémie: forme typhoïdique: Cette forme est plus rare mais plus sévère. Elle est considérée comme une forme septicémique. Elle peut être causée par l’ingestion d’aliments, d’eau contaminée, ou encore lors d'un repas avec des mains non lavées. En dehors des symptômes généraux, on peut observer des signes de gastroentérite et de toxémie, des lésions ulcéreuses peuvent apparaître sur les muqueuses de l’ensemble du tube digestif, s’accompagnant d’adénites cervicales, pharyngés et mésentériques. Les formes pulmonaires sont assez fréquentes. On peut aussi n’observer que des signes généraux et le diagnostic est alors difficile. L’évolution peut être courte et sévère suivant la virulence de l’espèce en cause.
7/ Tularémie: formes atypiques: Des éruptions cutanées (tularémides) peuvent s’observer dans 10 à 20 % des cas (tularémides). Des cas de méningites, d’endocardites, de péricardites, de pleurésies, de péritonites sont possibles. Des insuffisances rénales aiguës et des hépatites peuvent survenir.
- L’évolution de la maladie est de trois à cinq semaines et le taux de mortalité peut-être de 1 à 10 % en l’absence de traitement et suivant l'agent causal et sa virulence. La convalescence est longue de plusieurs semaines à plusieurs mois. L’asthénie peut persister plusieurs semaines. Le traitement doit être très précoce, il faut intervenir avant l’apparition d’adénopathies, autrement, même convenablement traitée par des antibiotiques efficaces, l’affection prend une allure traînante et handicapante. Il est fondé sur l’emploi des aminosides et des fluoroquinolones pendant au moins quinze jours.
- Physiopathologie
Outre le tropisme d'espèce très prononcé pour les rongeurs, les lagomorphes et accidentellement l'homme, il convient d'indiquer le tropisme du derme et d'organes avec l'atteinte du système réticulo-histiocytaire (ganglions lymphatiques, rate, foie). Il s'agit de bactéries intracellulaires strictes, du moins in vivo.
Aprés pénétration (cutanée la plus courante ou d'une muqueuse), le germe se multiplie localement, et gagne les ganglions lymphatiques locaux pour passer finalement dans le sang. Après phagocytose par les macrophages, F. tularensis inhibe la fusion phagosomes-lysosomes mais une acidification des phagosomes est indispensable à la multiplication bactérienne.
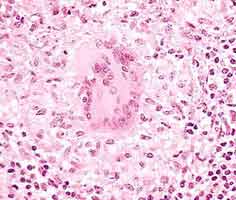
Puis elle se multiplie dans le foie (multiple abcès visibles à l'oeil nu) et la rate (splénomégalie marquée)(cf image ci-dessus). La réponse immunitaire, principalement à médiation cellulaire, est responsable de la formation de granulomes (cf ci-dessous). Son nouveau passage dans le sang provoque une septicémie, souvent mortelle chez l'animal.
|
|
 |
http://www.unbc.ca/nlui/wildlife_diseases/tularemia.htm
http://web.mpiib-berlin.mpg.de/cgi-bin/pdbs/2d-page/extern/index.cgi
- Les facteurs de pathogénicité commencent à être mieux connus avec la mise en évidence de l'excrétion de la phosphatase acide qui inhibe rendement ("burst") oxydatif des polynucléaires comme déjà rapporté pour deux autres pathogènes intracellulaires: Leishmania et Legionella. Mais elle possède aussi un LPS apparemment commun à toutes les souches dont l’activité endotoxinique est faible. Car, il n'induit pas la synthèse d'IL-1 par les cellules mononucléées et provoque la synthèse de faibles quantités de TNF par les macrophages. Le LPS semble nécessaire pour la croissance intra-macrophagique. La capsule joue un rôle dans la virulence, les souches non capsulées étant peu pathogènes. Enfin celle-ci n'est pas indispensable à la survie dans les phagocytes mais joue un rôle essentiel pour la résistance au pouvoir bactéricide du sérum.
- Diagnostic biologique
- Le diagnostic peut être difficile, d'autant que la maladie est rare en France (29 cas en 1991). Cependant en zone d'endémie, le contexte épidémiologique est quelquefois évocateur, donc à préciser impérativement au biologiste:
La tularémie est une maladie relativement méconnue par beaucoup de praticiens et de microbiologistes. Elle reste, dans l’esprit de beaucoup, une maladie un peu particulière très liée aux lièvres et aux chasseurs (ou aux femmes de chasseurs pour sa participation active à la une préparation culinaire) et n’est pas reconnue comme une affection pouvant être contractée dans un environnement rural de façon plus générale au contraire d'autres affections comme la brucellose, la borréliose de Lyme ou encore la leptospirose.
Ne pas oublier de pratiquer une sérologie de la tularémie en parallèle à celles de brucellose......
- Plusieurs caractéristiques doivent être prises en compte sur l'éventuelle survenue de cette maladie:
1/ Toute l'année mais avec deux pics (automme et hiver) mais aussi en été après randonnée pédestre, promenade en forêt ou travaux des champs.
2/ Patient consultant souvent pour une adénopathie douloureuse fistulisée d'un membre supérieur ou inférieur dans un contexte fébrile ou encore syndrome pseudo-grippal.
3/ Noter aussi la notion de chasse officielle ou non, de manipulation de viande, dépeçage de gibier, y compris congelée.
4/ Plus rarement, contact direct ou indirect avec un petit rongeur ou leurs excréta ou leurs parasites externes.........
5/ Piqûre par un insecte piqueur/suceur hématophage (tique, moustique.......)
6/ Contact avec des sangliers, renards, écureuils, carnivores domestiques à la campagne, des NAC, après des parties de pèche..............
- Heureusement, le biotype trouvé en France de Francisella est d'une virulence modérée et la maladie même si elle provoque un état de fatigue important, peut rester bénigne et évoluer vers la guérison progressivement. La symptomatologie est très protéiforme, le plus souvent il s'agira d'un état grippal.
Le diagnostic direct par culture est difficile. Il s'agira, le plus souvent, d'une découverte fortuite suite à une culture de ponction ganglionnaire, de sang (hémoculture) ou encore à partir d'une lésion cutanée.
|
ATTENTION AGENT DE LA CLASSE BIOLOGIQUE 3 (F. tularensis subsp. tularensis) |
 |
* Prélèvements à effectuer:
1/ Sérosité au point d'inoculation (+++)
2/ Ponction d'une adénopathie, la plus précoce possible, la culture se négativant vers le 10 ème jour
3/ Exsudats dans les formes conjonctivales ou pharyngées
4/ Hémocultures devant un tableau de fièvre ou de septicémie
5/ Rincage oro-pharyngé dans les formes angineuses
|
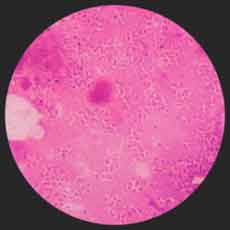
* Examen microscopique: Il est rarement positif à partir de la ponction ganglionnaire. Il peut s'agir d'une ou plusieurs hémocultures positives, au mieux au deuxième ou troisième jour d'incubation en aérobiose. |
 |
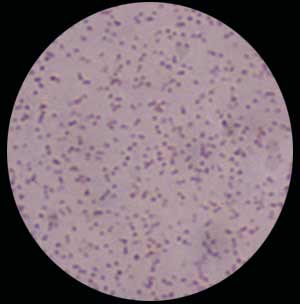
- On peut lui préférer une coloration de type MGG ou Bleu de méthylène.
* Culture : Elle est lente (48 h à 5 jours au moins) et difficile à 37°C en aérobiose (quelques souches poussent en présence de 5-7 % de CO2). Il convient d'utiliser des milieux enrichis, en particulier en cystéine tels la gélose chocolat enrichie (Polyvitex®), au sérum, glucosée ou encore au jaune d'oeuf ou flacons pour hémoculture ou encore le milieu BCYE (sans antibiotique). La croissance est faible et lente (3-6 jours) sur la gélose au sang frais, aucune hémolyse n'est observable.
Sur milieu solide (gélose chocolat), on obtient de petites colonies présentant un aspect nacré assez caractéristique (glaireux).
Enfin il convient de connaitre la nécessité de conserver les flacons d'hémoculture, au moins 21 jours.
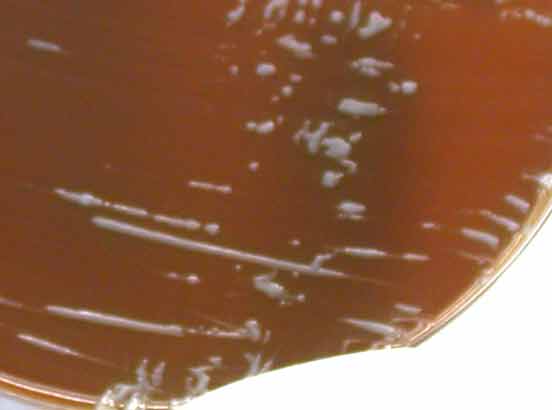

|
|
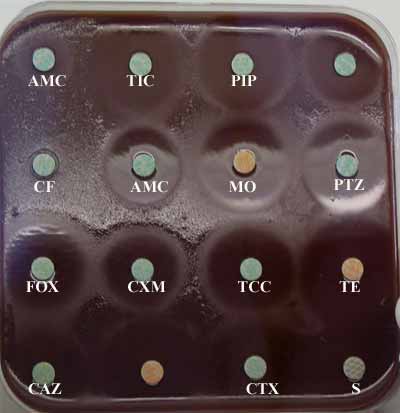
* Identification : d'abord présomptive basée sur la discordance de croissance en aérobiose entre une gélose nutritive (trypticase soja, par exemple à gauche) et une gélose chocolat supplémentée (à droite). |
|
|
|
Dès la suspicion constatée, travailler avec masque et gants en hotte

- Quelques caractères d'orientation peuvent aider au diagnostic :
|
1
|
catalase faible |
|
2
|
oxydase négative |
|
3
|
API 20E : pas de caractères positifs (uréase + pour Brucella) |
|
4
|
API 20NE : pas de caractères positifs |
|
5
|
API NH : glucose (GLU)+, fructose (FRU)+, PAL GGT +, lipase + (24 h) |
Exemple d'identification (F. tularensis subsp. holarctica) avec la galerie API NH
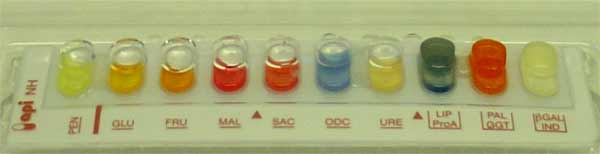
L'automate Vitek-2 (bioMérieux) permet l'identification de F. tularensis subsp. holarctica.
 |
- Si vous disposez d'un immunsérum anti-Francisella, une agglutination rapide sur lame sera effectuée avec une suspension bactérienne inactivée par ébullition quelques minutes. |
D'autres caractères d'identification peuvent être recherchés: http://www.bacterio.cict.fr/bacdico/ff/francisella.html
- Puis envoyer la souche pour identification définitive au Centre National de Référence (CNR) récemment créé en France (2002) :
http://www.invs.sante.fr/surveillance/cnr/liste_cnr_200705.htm

http://www.sante.gouv.fr/adm/dagpb/bo/2002/02-41/a0413306.htm
| * L'amplification génique (PCR) est possible sur produit pathologique (ganglion, par exemple) lors de diagnostic précoce et d'une très forte présumption compte tenu des commémoratifs et des éléments cliniques récoltés. Il est aussi possible d'amplifier le gène codant pour la lipoprotéine de surface de 17 kDa (0,5 kb). - Cependant cette technique est très utile au diagnostic de genre, voire d'espèce directement ou après culture pour une identification plus rapide et plus sûre: Des amorces spécifiques du gène de l'ARNr 16S sont ainsi disponibles. Accessoirement le produit d'amplification de 1,1 kb est séquencé. Il est alors possible de différencier F. tularensis subsp. tularensis de F. tularensis subsp. holartica. |
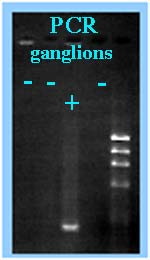 |
D'autres amorces ont été proposées comme celles du gène codant pour la lipoprotéine de 17 Kda qui permettent la détection du genre Francisella).
- Le diagnostic sérologique est la méthode la plus utilisée et la plus fréquemment positive faisant appel à la réaction classique de macroagglutination en tube (cf ci-dessous) soit encore à une réaction d'immunofluorescence indirecte (IFI) ou ELISA. Ces réactions ont une spécificité médiocre, en particulier à la phase initiale:
|
* Précoce : positive au 10ème jour, au mieux, peut nécessiter 3 semaines (> 1/40 ème) |
 |
|
|
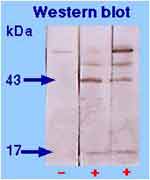 |
Diagnostic allergique
La recherche d'une hypersensibilité retardée par l'intradermo-réaction à la tularine qui est sensible, spécifique et précoce n'est plus disponible en France, en l'absence d'antigène commercial.
- Pouvoir pathogène expérimental
Compte tenu de la difficulté de diagnostic biochimique de cette bactérie, il est possible quelquefois, de tester la virulence de la souche isolée en inoculant une souris par voie IP ou SC, si possible, disposer d'une animalerie protégée.
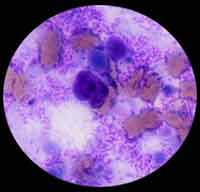
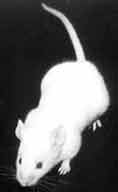
| La souris meurt de septicémie en 2 à 12 jours avec une adénopathie satellite et une splénomégalie (> 2 jours). A droite: Empreinte de la rate d'une souris infectée et morte à J6 par voie sous-cutanée après coloration de type MGG. |
 |
 |
NE PAS OUBLIER DE TRANSMETTRE LES DONNÉES (MDO)
http://www.sante.gouv.fr/adm/dagpb/bo/2002/02-41/a0413306.htm
La surveillance épidémiologique repose sur la notification des cas, sur l'envoi de la souche isolée ou des produits pathologiques pour identification du germe et typage des souches au CNR de la tularémie à l'AFSSA de Maisons-Alfort, et sur l'envoi du sérum au laboratoire de microbiologie du centre hospitalier de Cahors.
 Laboratoire d'études et de recherche en pathologie animale et zoonoses de l'AFSSA, unité des zoonoses bactériennes, 23, avenue Charles-de-Gaulle, B.P. 19, 94701 Maisons-Alfort Cedex, Dr Vaissaire (Josée), tél. : 01-49-77-13-00, courriel : j.vaissaire@afssa.fr, fax : 01-43-68-97-62 |
 Centre hospitalier, 335, rue du Président-Wilson, B.P. 269, 46005 Cahors, Dr Le Coustumier (Alain), tél. : 05-65-20-50-75, courriel : lecoustumier@ch-cahors.fr, fax : 05-65-20-51-10, |
- Sensibilité aux antibiotiques - Traitement
. In vitro, cette bactérie est sensible à de nombreux antibiotiques tels aminosides (streptomycine, gentamicine), tétracyclines (doxyxycline, minocycline), macrolides (érythromycine), synergistines (pristinamycine), phénicolés (chloramphénicol) et fluoroquinolones (ofloxacine, ciprofloxacine).
En pratique, l'antibiogramme sera réalisé sur une gélose de Mueller-Hinton au sang cuit enrichie en Polyvitex® incubée à 37°C durant 48 h. Un E-test pourra être effectué pour préciser la CMI d'un antibiotique lors de doute.
. La résistance naturelle s'observe en particulier vis-à-vis des ß-lactamines dont les pénicillines à large spectre et les céphalosporines (céfalotine, céfuroxime, céfoxitine), l'imipénème reste très actif. Donc un coccobacille à Gram-négatif, oxydase - catalase + faible et résistant aux C3G ..........
. Une synergie est obtenue entre l'amoxicilline ou la ticarcilline et l'acide clavulanique. Pour l'érythromycine, on retiendra la résistance du biotype II de F. tularensis subsp. holarctica.
. La résistance acquise n'apparait guère conséquente actuellement. D'ailleurs cette absence liée à une standardisation insuffisante de l'antibiogramme ne justifie pas réellement sa mise en oeuvre, si ce n'est à cause de son intérêt taxonomique.
. Le traitement classique qui devra être le plus précose possible s'appuiera sur les antibiotiques suivants: streptomycine à la dose de 30 mg/kg en IM pendant 10-14 j ou la gentamicine à la dose de 5 mg/kg/j par la voie IV pendant 10 j, l'alternative classique était la doxycycline (200 mg/j per os pendant 14-21 jours). Plus récemment, les fluoroquinolones ont montré leur efficacité dont la ciprofloxacine (1g/24 h en 2 prises orales) ou l'ofloxacine (800mg/24 h en 2 prises orales).
* Une association d'antibiotiques est recommandée à la phase précoce jusqu'à la régression de l'adénopathie.Un drainage ganglionnaire peut être nécessaire avec une durée de traitement de 3 semaines.
http://www.eurosurveillance.org/em/v09n12/0912-134.asp
- Prophylaxie
Chez l'homme
Mesures générales: lutte contre les réservoirs et les vecteurs. Information des populations.
Prophylaxie sanitaire
. Emploi d'insecticides.
. Usage de vêtements de protection contre les arthropodes dans les zones d'enzootie (cf Borrelia).
. Emploi de masques, de gants et de lunettes pour manipuler les dépouilles d'animaux sauvages.
. Désinfecter le pelage à l'alcool à 70°C avant autopsie.
. Ne pas boire d'eau non traitée en zone suspecte ou giboyeuse et bien cuire les viandes d'animaux sauvages en région d'enzootie.
. Respecter les règles générales d'hygiène.
|
Prophylaxie médicale: La faible fréquence de la maladie en France n'a pas justifié la mise en oeuvre d'un plan de vaccination comme dans d'autres pays. Leur efficacité dépend des voies de contamination (inoculum infectant ?). L'antibioprophylaxie sera à base de fluoroquinolones (par exemple chez l'adulte, ciprofloxacine 1 G/jou en 2 fois ou encore ofloxacine, lévofloxacine) ou encore doxycycline 100 mg q 12 h per os pendant 14 j, ou tétracycline 500 mg po durant 14 j. |
 |
Chez l'animal
Prophylaxie sanitaire défensive: Agir sur le réservoir animal par le contrôle des densités de petits mammifères, lutter contre les arthropodes piqueurs, limitation des importations de lièvres d'Europe Centrale.
. Protection des élevages: quarantaine de déparasitage des nouveaux animaux, antibioprévention (streptomycine, tétracyclines) lors d'infection déclarée dans un élevage d'ovins ou de primates.
. Protection des locaux contre les rongeurs sauvages et séparation géographique, réelle, des espèces (pour éviter une contamination par des puces par exemple).
Prophylaxie sanitaire offensive: La tularémie n'est plus une maladie réputée légalement contagieuse depuis 1996 (MLC) chez toutes les espèces de rongeurs et de lagomorphes domestiques et sauvages. Leurs importations, morts ou vivants, ou celles de leur peau est soumise à contrôle. Ainsi des cas de tularémie ont été récemment observés en Belgique chez des chiens de prairie importés des USA.
Mesures de police sanitaire: Malheureusement, il n'y a plus actuellement obligation de déclarer tout rongeur ou lagomorphe vivant ou mort suspect de tularémie ainsi que toute mortalité élevée de lièvres ou lapins de garenne.
Pour les rongeurs et lagomorphes sauvages, une information est diffusée par l'ONC (http://www.oncfs.gouv.fr/) et le réseau SAGIR.
http://www.invs.sante.fr/publications/guides_biotox/guide_tularemie.html
http://www.sante.gouv.fr/htm/pointsur/zoonose/11z.htm
www.agmed.sante.gouv.fr
www.ifrance.com/maladies-a-tiques
http://www.who.int/topics/tularaemia/fr/
http://www.vet-lyon.fr/ens/faune/Fiches/Syntheses/tularemie_synth.htm
http://www.bt.cdc.gov/agent/tularemia/index.asp
http://umvf.cochin.univ-paris5.fr/article.php3?id_article=689
http://www.orpha.net/consor/cgi-bin/home.php?Lng=FR
http://www.dsmz.de/microorganisms/main.php?contentleft_id=14
http://www.oncfs.gouv.fr/events/point_faune/suivi-sanitaire.php
Revue générale: J.Vaissaire,C. Mendy, C. Le Doujet, A. Le Coustumier. La Tularémie. La maladie et son épidémiologie en France. Médecine et maladies infectieuses; 2005, 35: 273–280
Ancienne version (22.05.99), Nouvelle version (03 09.05).
|
|
|
|
|