S. SAPROPHYTICUS


1 - Introduction
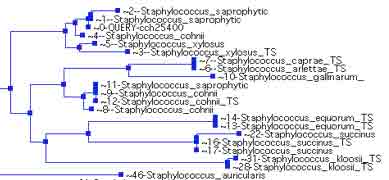
Le genre Staphylococcus regroupe 44 espèces et sous-espèces. Des études d’hybridation ADN-ADN ont permis de définir en 1990 différents groupes dont le groupe S. saprophyticus comprenant 3 espèces et leurs sous-espèces (S. saprophyticus subsp. saprophyticus et S. saprophyticus subsp. bovis ; S. cohnii subsp. cohnii et S. cohnii subsp. urealyticus ; S. xylosus. Saphylococcus succinus nouvelle espèce isolée d’ambre est reliée à ces espèces, ainsi que S. gallinarum. Staphylococcus hominis subsp. novobiosepticus et S. fleurettii sont récemment décrites (16, 32, 33, 49, 55). Ces staphylocoques ont une caractéristique phénotypique commune: ils résistent à la novobiocine (http://www.bacterio.cict.fr).
2 - Habitat
2.1-Homme
En dehors des urines où il est d’ailleurs rarement contaminant, S. saprophyticus a été isolé dans 1 à 2 % de chacun des sites suivants (avec une légère prédominance chez la femme) : flore digestive, rectale, périnéale, péri-urétrale, urétrale, vaginale, et exceptionnellement de la peau (25, 36). Des milieux sélectifs sont nécessaires à son isolement systématique.
En 1986, Ringertz et al. (48) à Stockholm ont recherché chez près de 1000 consultants pour maladies sexuellement transmissibles la prévalence du portage. Les résultats furent (H/F) : urètre 4,2 / 2,5 %; rectum 2,6 /2,5 %; col utérin, 1,6 %.
La variation saisonnière était très nette, le maximum de portage étant observé en été et au début de l’automne : rectal 6,7 % (H et F) et urétral 10,6 % (H) et 7,4 % (F). Le milieu d’ensemencement utilisé pour cette étude était un bouillon trypticase soja supplémenté par 150 mg/L d’acide nalidixique et 2 mg/L de novobiocine, incubé 48h à 37°C, avec sub-culture sur gélose à 5 % de sang de cheval. Les auteurs concluaient que la présence de Staphylococcus saprophyticus dans le tube digestif évoquait la possibilité d’une contamination alimentaire.
Niche écologique particulière : Reuther et Noble en 1993 (47) ont analysé 10 000 souches de staphylocoques résistants à la novobiocine isolées de pieds. Les souches en grande quantité (>105 ufc/cm2) étaient surtout S. cohnii (dominant chez les hommes) et S. saprophyticus (dominant chez les femmes de 10 à 29 ans).
2.2-Animaux et aliments
Hedman et al. (19) ont en 1993 écouvillonné le rectum d’animaux à l’abattoir. Les prélèvement ont été positifs avec S. saprophyticus pour 7,1 % des bœufs et 7,3 % des porcs. Les vaches au pâturage étaient positives dans 1,6 % des cas ; en stabulation, le taux de positivité passait à 12,4 %.
L’animal est donc un réservoir de S. saprophyticus.
Ces auteurs en 1990 (17), ont testé à Stockholm sur une période d’un an, plus de 1300 échantillons alimentaires variés recueillis dans des restaurants, alimentation collective et une usine de conditionnement de viande crue, de bœuf et de porc. S. saprophyticus a été retrouvé dans 16,4 % des contrôles et dans 34 % des échantillons de bœuf et de porc crus. Les gants du personnel étaient colonisés par cette espèce dans 69 % des cas.
Aucune variation saisonnière de portage ou colonisation n’a été observée chez l’animal.
S. saprophyticus a été retrouvé dans de nombreux aliments : poulets et œufs (24 %), poissons (13 %), légumes (6 %), lait (7 %), pain (5 %), salami grec..
Les conditionnements froids sont contaminés par les aliments stockés.
La variation saisonnière des infections chez l’homme s’expliquerait dans le Nord de l’Europe par l’alimentation consommée plus volontiers crue en été (viandes marinées, salées, fumées, peu grillées etc).
3 - Pouvoir pathogène
3.1-Infections urinaires
Connu comme responsable d’infection urinaire dès 1962 (45), “ Micrococcus sous-groupe 3” renommé en 1975 (49), S. saprophyticus a surtout été étudié dans les pays du Nord de l’Europe en particulier par les Suédois (années 1975-90), puis plus tard, au Canada, en Angleterre, aux Etats Unis d’Amérique. En France, le pouvoir pathogène de ce germe (facile à identifier) est connu, mais la prévalence des infections a suscité peu de publications, d’autant que S. saprophyticus n’est pas un germe hospitalier, mais un germe “ de ville ”.
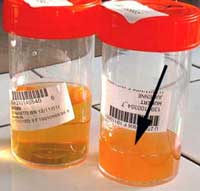
Les infections urinaires surviennent chez la femme jeune (15-25 ans), non hospitalisée, enceinte ou non (18, 50) ; plus rarement chez le jeune homme ou le vieillard. L’infection urinaire symptomatique à S. saprophyticus se définit au laboratoire par une pyurie (position 1 sur la bandelette, voir photo): > 103 leucocytes/mm3 d’urines non centrifugées, et une numération bactérienne : >105 ufc/ml, ou > 104 ufc/ml pour Stamm 1988 (52).
| Les bandelettes détectant les nitrites sont toujours négatives, car S. saprophyticus ne possède pas de nitrate–réductase (position 2 sur la bandelette, voir photo):. |
 |
En cas de cystite récidivante, il est conseillé d’accepter des numérations >102 ufc/ml, car cette bactérie adhère aux cellules uro-épithéliales. Ces mêmes valeurs sont acceptées en cas de cathétérisme rénal ou de ponction sus-pubienne ou pour les urines de mi-jet, en cas de signes cliniques patents alors que le staphylocoque est le seul germe isolé.
Les symptômes cliniques ressemblent à ceux d’une infection à E. coli, cystite simple avec dysurie, ou cystite hémorragique. L’infection urinaire, peut se compliquer de pyélonéphrite avec douleurs lombaires intenses, fièvre élevée.
Une des caractéristiques des infections à S. saprophyticus est qu’elles se compliquent de lithiase de l’appareil urinaire avec ou non hydronéphrose. La production d’une uréase explique la formation des calculs (29) : la libération d’urée augmente le pH de l’urine (pH 6-8) et la formation de cristaux de phosphates ammoniaco-magnésiens. Ce processus est le même dans les infections urinaires à Proteus. Les récurrences sont évaluées à 10 % des infections du tractus urinaire (29, 44).
L’infection urinaire asymptomatique à S. saprophyticus se définit par une numération bactérienne > 105 ufc/ml, sans pyurie, pour 2 urines consécutives (24, 41).
Les infections urinaires asymptomatiques affectent 1,2 % des adolescentes, et 5 % des femmes sexuellement actives. Elles sont, en général, transitoires et sans conséquence, mais peuvent évoluer (moins de 10 % des cas) dans la semaine qui suit en infection urinaire symptomatique (14)
Les infections urinaires asymptomatiques semblent plus importantes à surveiller dans des groupes à risque : femme enceinte, cathétérisme vésical, vieillard (41).
La prévalence des infections urinaires: S. saprophyticus est le deuxième germe en fréquence chez la jeune femme non hospitalisée, après E. coli.
Les pourcentages relatifs d’infections urinaires à S. saprophyticus (3, 5, 30, 34, 36, 44, 50, 56) en ambulatoire varient de 7 à 22 % (femmes de tous âges) à 30-42 % (jeunes femmes de 16-25 ans).
En milieu hospitalier, les chiffres sont de 0,07 à 0,5 % des infections urinaires.
En 2001, 64 souches de S. saprophyticus sur 11836 souches de staphylocoques, soit 0,5 % dont 88 % isolées d’urines, ont été isolées aux Hospices Civils de Lyon (http:// lyon-sud.univ-lyon1.fr/bacterio/college/).
Le tableau ci-dessous précise la distribution des germes d'origine urinaire observée entre 2001 (Janvier) et 2003 (Mai) chez la femme de moins de 45 ans venue au Service des Urgences de l'hôpital Cochin.
|
Distribution (677 souches)
|
Fréquence (%)
|
| E. coli |
79,6
|
| S. saprophyticus |
5,5
|
| E. faecalis |
2,5
|
| K. pneumoniae |
2,4
|
| P. mirabilis |
1,8
|
| S. agalactiae (groupe B) |
1,8
|
| Autres entérobactéries |
4,7
|
| S. aureus |
0,6
|
Les facteurs de risque sont : diaphragme avec gel spermicide, usage de préservatifs enduits de spermicide, rapport sexuel récent (11, 24, 41).
3.2-Autres infections:
. cystites et uréthrites aiguës non gonococciques (27).
. péritonites lors de dialyse péritonéale ambulatoire continue, où serait retrouvé majoritairement (44 % des cas versus S. aureus 5 % et S. epidermidis 7 % (9).
. endocardite infectieuse sur valve aortique native avec terrain favorisant : toxicomanie IV, alcoolisme, hypertension artérielle pulmonaire (51).
. endophtalmies après chirurgie pour cataracte en Finlande (43). Il contamine parfois les tissus pour greffe de cornée (6).
. arthrite septique chez un nouveau-né avec septicémie (8).
. affections cutanées : S. saprophyticus est exceptionnellement retrouvé dans 1/18 kystes, mais dans aucun furoncle, folliculite ou abcès (2).
. pneumopathies nosocomiales (22).
4- Physiopathologie
Cette bactérie adhère aux cellules épithéliales (54) par l’intermédiaire de protéines, adhésines de surface : Surface associated protein (Ssp), qui est une protéine fibrillaire de 95 KDa (13) ; une protéine de 160 KDa qui correspond à l’hémaglutinine (14, 26) ; une autolysine/adhésine (21) appartenant à une nouvelle classe d’adhésines (AaS) qui se lie à la fibronectine et aux érythrocytes.
Les souches de S. saprophyticus possèdent des structures appendiculaires de surface (fimbriae-like) de longueur et d’épaisseur différente. Les plus longs adhèrent de façon réversible à la cellule (augmentation de l’hydrophobicité, neutralisation de la barrière des charges électro-négatives), permettant in fine l’action des adhésines proprement dites qui sont portées par les fimbriae courts et épais. L’adhésion est alors irréversible.
L’acide lipotéichoïque joue un rôle dans son adhérence aux cellules uroépithéliales (54).
Mais n’a pas d’influence sur la mobilité des spermatozoïdes (à la différence d’E. coli, P. aeruginosa ou C. albicans) (28). Enfin S. saprophyticus est dépourvu de protéine A et de récepteurs pour la transferrine (39).
5- Diagnostic biologique
|
Le diagnostic bactériologique est simple en 24/48h dans le cadre, le plus souvent d'une infection urinaire aiguë de la jeune femme. Il s'agit donc d'un examen cyto-bactériologique des urines. Celles-ci sont le plus souvent troubles, avec leucocyturie et bactériurie. |
 |
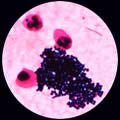
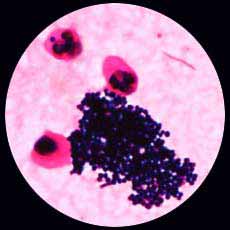
5 . 1 - L'examen direct après coloration de Gram est le plus souvent contributif:
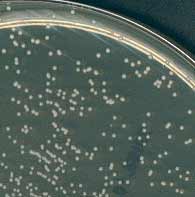
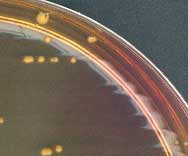
5 . 2 - La culture pour isolement ne pose guère de problèmes en raison de l'absence d'exigences de culture particulières. La gélose trypticase ou columbia au sang (mouton ou cheval) convient bien pour sa croissance en 24 h à 37°C en atmosphère ambiante : les colonies sont non hémolytiques, de 3 à 9 mm de diamètre, circulaires, à bords réguliers, très brillantes, opaques, crémeuses, convexes, non pigmentées ou pigmentées en jaune orange. Enfin certaines souches poussent sur le milieu de Chapman (à droite).
 |
 |
 |
Il existe des milieux pour identification présomptive :
|
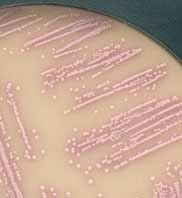
- milieux chromogènes récemment commercialisés tel CHROMagar TM Orientation (Becton Dickinson, Pont de Claix). Les colonies de S. saprophyticus apparaissent roses. |
 |
- gélose trypticase soja supplémentée par 0,3 g d’extrait de levure, plus 1,6 mg/l de novobiocine sert de milieu d’isolement avec identification présomptive.
- milieux avec indicateurs colorés : ces milieux ont pour la plupart été mis au point pour différencier rapidement S. saprophyticus de S. xylosus et S. cohnii qui sont les staphylocoques résistants à la novobiocine les plus fréquents en clinique humaine. En fait, la description de nouvelles espèces rend ces milieux moins performants.
. milieu de Morgan, (40) : bouillon cœur cervelle avec du rouge de phénol, supplémenté d’une part par 1,6 mg/l de novobiocine et 1 % de D (+)-turanose, et d’autre part, par 1 % de L (+)-arabinose, sans novobiocine. La méthode se fait en microplaques (inoculum de 1,5.105 ufc/m). Les cupules sont recouvertes d’huile minérale stérile. Les résultats se lisent selon l’acidification et la croissance. S. saprophyticus est turanose positif, arabinose négatif et résiste à la novobiocine. Les nouvelles espèces novobiocine résistantes décrites depuis : S. arlettae, S. gallinarum, S. equorum, sont turanose et arabinose +, ce qui les rend non distinguables de S. xylosus.
- milieu de Cristino : gélose Columbia supplémentée par 1 % de glucose et 0,00 2% de bromocrésol pourpre. Ce milieu est supplémenté par 1 % de mannose et 5 mg/l de novobiocine. S. saprophyticus, dépourvu d’activité phosphomannose isomérase est mannose négatif à la différence de S. xylosus et de certaines souches de S. cohnii qui sont mannose positifs et aussi résistantes à la novobiocine.
5.2 -Identification (7bis, 12)
5.1-Identification du genre Staphylococcus :
Ce sont des diplocoques et amas de cocci à Gram positif et catalase positive. A l’inverse des “ microcoques ”, les staphylocoques sont oxydase négative (sauf S. sciuri, S. lentus, S. vitulinus et S. fleurettii) , sensibles à la nitrofurantoïne et acidifient le glycérol (exception, Kocuria kristinae est un “ microcoque ” glycérol positif).
| Catalase : eau oxygénée à 0,3% (10 volumes) avec des colonies de 18 à 24 h. Se fait en tube ou sur lame de verre. Réactif commercialisé : ID color Catalase bioMérieux, réf. 55 561 contient un agent épaississant et un colorant rendant la réaction plus lisible et plus stable. Le dégagement immédiat de bulles d’oxygène exprime la présence d’une catalase. |
 |
- Oxydase (tétraméthyl-p.phénylène diamine) : Oxydase (bioMérieux, oxidase reagent réf. 55635, ou DrySlide TM Oxidase Difco Laboratories, réf . A 3530-75 ou réactif Oxydase Fischer, réf. A53030753. La coloration violette signe la présence d’une oxydase.
- Acidification du glycérol : Purple Agar Base Difco réf. 0228-1-7, contenant 1% de glycérol Merck, réf. 104094. Ne pas ajouter d’érythromycine (formule initiale 0,4 mg/l), car des souches sont sensibles à cette concentration. Le virage au jaune du PAB est en faveur d’un staphylocoque.
- Furanes : disque chargé de 300 mg de nitrofurantoïne, bioMérieux, réf. 5422, ou de furanes, Biorad, réf. 68678. Le milieu utilisé est le Mueller-Hinton gélosé (cf antibiogramme). Le diamètre critique est 15 mm.
- Acide nalidixique : La résistance naturelle aux quinolones des bactéries à Gram-positif dont les staphylocoques se recherche dans les conditions décrites ci-dessus (cf antibiogramme), avec un disque chargé de 30 µg d’acide nalidixique (aucune zone d’inhibition). Les souches de S. cohnii et S. xylosus laissent une petite zone d’inhibition autour du disque.
Les CMI sont élevées, de 128 à 512 mg/l pour S. saprophyticus, alors qu’elles sont sensiblement plus basses, de 16 à 128 mg/l pour les souches décrites sensibles à la novobiocine (ex. S. epidermidis).
5.2-Identification d’espèce:
5.2.1-Eliminer S. aureus
A cause de la croissance de certaines souches sur le mileu de Chapman ainsi que d'une éventuelle pigmentation jaune oblige à cette distinction.
Coagulase : 0,1 à 0,5 ml d’une culture en bouillon cœur-cervelle de 18 h sont portés dans 0,5 ml de plasma de lapin citraté (bioMérieux réf. 55181 ou 2) ou supplémenté d’EDTA (Difco, réf. 0803-46-5). La lecture est effectuée après 2 h, 4 h et 24 h d’incubation à 35°C. Un précipité fibrineux ou floconneux doit être considéré comme un résultat négatif.
Attention aux faux positifs (protéases ou pseudo-coagulases, pour la plupart, inhibées par l’EDTA). Une contamination par une autre bactérie consommatrice de citrate est également possible.
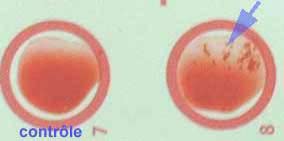
Facteur agglutinant : les réactifs commercialisés sont à base de particules de latex sensibilisées principalement par du fibrinogène associé à d’autres constituants, protéine A, antigènes capsulaires ou des antigènes de surface spécifiques de S. aureus ((Pastorex Staph-Plus, Biorad, réf .56356, Slidex Staph Kit bioMérieux, réf. 73112, Slidex Staph-Plus, bioMérieux, réf. 73115 et 73 116 ) etc.
| Attention aux faux positifs observés pour S. saprophyticus avec certains réactifs commercialisés, par adhésion à la fibronectine ou à des constituants similaires présents à l’état de traces dans ces réactifs (46). Il est important d’utiliser des kits comportant un réactif témoin constitué de particules de latex non sensibilisées afin de détecter une autoagglutination ou la présence d‘une hémagglutinine naturelle (réactifs contenant aussi des globules rouges). Les milieux ayant une forte teneur en sel ne sont pas recommandés, car ils favorisent l’autoagglutination. |
 |
Certains laboratoires très spécialisés court-circuitent ces tests conventionnels et identifient toute colonie présomptive d’être un staphylocoque par des techniques génotypiques:
Recherche par une sonde spécifique (non commercialisée) du gène de la thermonucléase (nuc) de S. aureus, seule, ou associée à la recherche du gène mecA de résistance à l’oxacilline.
En cas de doute, de souche atypique problématique, on peut éliminer S. aureus par le kit Accuprobe® S. aureus (Gen-Probe, réf. 2875 : bioMérieux , réf. 39203) qui utilise une sonde ADN monocaténaire permettant l’identification de S. aureus, par détection en chimioluminescence des ARN ribosomaux spécifiques.
|
S.saprophyticus est coagulase -, facteur agglutinant -, DNAse thermostable -, test Accuprobe -, gène nuc -. Il peut être gène mecA positif. |
5.2.2-Identifier S. saprophyticus,
Résistance à la novobiocine :
S. saprophyticus a été la première espèce de staphylocoque décrite ayant une résistance naturelle à cet antibiotique. Depuis, d’autres espèces résistantes sont venues compliquer la reconnaissance de S. saprophyticus (12).
A ce jour, 17 espèces ou sous-espèces résistantes à la novobiocine (CMI > 1,6 mg/l) sont décrites, dont 5 au moins ont été impliquées dans des infections humaines.
Les niveaux de résistance sont élevés (32-64 mg/L ou plus). En 1998, Kloos et al. (32) ont décrit une nouvelle espèce résistante à la novobiocine, Staphylococcus hominis subsp. novobiosepticus, isolée chez l’homme, principalement d’hémocultures. La dernière espèce résistante à la novobiocine décrite est S. fleurettii (55), isolée de fromages au lait de chèvre.
| En pratique, la résistance à la novobiocine est réalisée par inhibition de croissance autour d’un disque chargé de 5 µg de novobiocine (Biorad, réf. 56350). La zone d’inhibition des souches résistantes est < 12 mm si la culture est réalisée sur milieu trypcase soja contenant 5% de sang de mouton, ou < 16 mm sur milieu gélosé de Mueller-Hinton (à droite). Si la détermination de cette résistance est le seul test d’identification d’espèce effectué, sa valeur prédictive est de 93% (40) avec 3,4 % d’erreurs de diagnostic (36). |
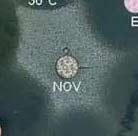 |
 |
Résistance à la fosfomycine : S. saprophyticus est résistant à la fosfomycine (35), dans plus de 97 % des cas (2 souches résistantes sur 64 souches isolées en 1999 aux H.C.L. de Lyon). Les disques sont chargés par 50 µg. Interprétation selon les critères du CA-SFM (http://www.sfm.asso.fr/nouv/general.php?pa=2), diamètre critique 14 mm. |
Identification biochimique:
S. saprophyticus est présent dans toutes les bases de données des systèmes d’identification. Quelques galeries biochimiques miniaturisées utilisées en France sont :
API Staph (bioMérieux, réf. 20 500), ID 32 Staph (bioMérieux, réf. 32 500), Cartes Vitek GPI (bioMérieux, réf. 51 1305), et Vitek 2 ID-GPC (bioMérieux, réf. 21313), PMIC/ID-25 (Phoenix® réf.448575)).
Exemple d'identification avec la galerie API STAPH


Exemple d'identification avec la galerie API ID 32 Staph
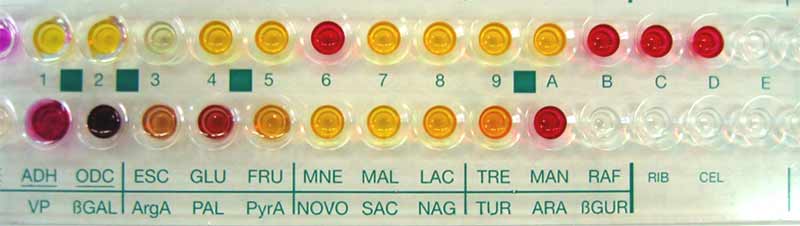
5.2.4-Détection génomique :
Une PCR spécifique existe pour S. saprophyticus, utilisable directement sur l’urine infectée (37). Sa sensibilité est de 19 ufc avec 30 cycles d’amplification et 0,5 ufc avec 40 cycles. Son temps d’exécution est de 90 miN.
- Il n'y a pas de diagnostic sérologique.
8 - Sensibilité aux antibiotiques - Thérapeutique
Ce germe est naturellement résistant à plusieurs antibiotiques pouvant être utilisés en routine: novobiocine (NOV), fosfomycine (FOS), mais sensible aux furanes (FT). Enfin, il est assez souvent résistant à l’acide fusidique (FA).
Il reste sensible (42), en particulier à : pénicillines dont la pénicilline G (P), oxacilline (OX), aminoglycosides (K, GM, TN, NET), tétracyclines (TET, MNO), triméthoprime (TMP), son association au sulfaméthoxazole (SXT), macrolides (ERY) bien que la résistance augmente (1, 4, 15).
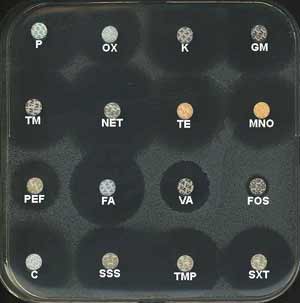

|
Le E-test permet de confirmer la sensibilité à la pénicilline G de nombreuses souches. La recherche chromogénique de la ß-lactamase est quelquefois effectuée pour des souches productrices (diamètres d’inhibition à la pénicilline G s'échelonnant de 29 à 31 mm). |
 |
S. saprophyticus est résistant à l’acide nalidixique (27, 56) s'accompagnant d'une résistance faible mais croisée avec les fluoroquinolones (PEF, péfloxacine), bien que des publications récentes (53, 23) traitent des succès obtenus en clinique par ces antibiotiques pour les infections urinaires non compliquées de la femme jeune, probablement en raison des taux physiologiques élevés atteints dans l’urine (23) : 217 mg/l d’urine (péfloxacine) et 493 mg/l d’urine (norfloxacine).
La résistance à la fosfomycine explique les échecs cliniques de fosfomycine-trométamol dans le traitement rapide des infections urinaires à S. saprophyticus.
La résistance aux glycopeptides et au linézolide est exceptionnelle (57), cependant (7), les CMI de la téicoplanine pour les souches de staphylocoques résistants à la novobiocine ont été trouvées plus élevées (2-8 mg/l) que celles des souches d’espèces naturellement sensibles (0,5-4 mg/l).
La résistance aux antiseptiques est surveillée dans les industries alimentaires où les ammoniums quaternaires sont largement utilisés : le gène qacH de résistance aux ammoniums quaternaires a été décrit chez S. saprophyticus isolé de volaille (20).
Conclusions :
Staphylococcus saprophyticus décrit par Fairbrother en 1940 (Grec adj. sapros putride ; Gr. n. phyton plante ; saprophyte cultivant sur des tissus végétaux en décomposition) est une bactérie pathogène, responsable d’infections urinaires chez la femme jeune non hospitalisée. Ses principaux caractères sont la sensibilité aux furanes, la résistance naturelle à la novobiocine, à la fosfomycine, souvent associée à la résistance à l’acide fusidique.
Le diagnostic bactériologique est simple et rapide: des tests biochimiques complémentaires sont utiles pour distinguer S. saprophyticus des autres souches résistantes à la novobiocine, en particulier S. cohnii et S. xylosus (surtout si le site d’isolement n’est pas une urine). S. saprophyticus acidifie le tréhalose, le mannitol et le turanose et n’acidifie pas le mannose et l’arabinose. En pratique vétérinaire, il faut penser aux autres espèces résistantes à la novobiocine, S. kloosii, S. sciuri, S. lentus et, en particulier, à S . fleurettii (oxydase +, D- cellobiose +).
1. Aarestrup, F. M., Y. Agers, J. C. Jorgensen, M. Madsen, L. B. Jensen. 2000. Antimicrobial susceptibility and presence of resistance genes in staphylococci from poultry. Vét. Microbiol. 74 : 353-364.
2. Akiyama, H., H. Kanzaki, J. Tada, J. Arata. 1998. Coagulase-negative staphylococci isolated from various skin lesions. J. Dermatol. 25 : 563-568.
3. Anderson, J., A. M. Clarke, M. E. Anderson, J. L. Isaac-Renton, M. G. McLoughlin. 1981. Urinary tract infections due to Staphylococcus saprophyticus biotype 3. CMA Journal. 124 : 415-418.
4. Andrews, J., J. Ashby, G. Jevons, T. Marshall, N. Lines, R. Wise. 2000. A comparison of antimicrobial resistance rates in Gram-positive pathogens isolated in the UK from October 1996 to January 1997 and from October 1997 to January. 1998. J. Antimicrob. Chemother. 45 : 285-293.
5. Baerheim, A., A. Digranes, S. Hunskaar. 1999. Are resistance patterns in uropathogens published by microbiological laboratories valid for general practice ? APMIS. 107 : 676-680.
6. Baldeschi, L., A. Lupetti, M. Nardi, C. Hintschich, J. Richard, O. Collins. 1998. A comparison of skin storage methods for oculoplastic surgery. Eye. 12 : 714-716.
7. Bannerman, T. L., D. L. Wadiak, W. E. Kloos. 1991. Susceptibility of Staphylococcus species and subspecies to teicoplanin. Antimicrob. Agents Chemother. 35 : 1919-1922.
7bis. Brun Y, Bes M., Vandenesch F. 2003. Actualités permanentes en Bactériologie clinique. In Freney J., Renaud F. Bollet C., et Leclercq (Eds), Eska, Paris, 2003. Section IV, chapitre 1. 55 pages.
8. Codita, I., O. Dorobat, V. Dumitrescu. 1995. Staphylococcus saprophyticus isolated in blood cultures from normal-weight newborn infants with septic arthritis. Bacteriol. Virusol. Parazitol. Epidemiol. 40 : 153-157. Résumé anglais.
8bis. Cristino JA, Pereira AT, Mira ML, Manso C. 1987. Mannose inhibition as a significant marker for differentiating among
novobiocin-resistant staphylococci of relevance in clinical microbiology. J. Gen. Microbiol. 133:1419-1421.
9. Drinovec, J., A. Bren, A. Gucek, J. Linndic, A. Kandus, R. Ponikvar. 1988. The treatment of staphylococus peritonitis in patients on continuous ambulatory peritoneal dialysis. 7 : 46-48.
10. Echols, R. M., R. L. Tosiello, D. C. Haverstock, A. D. Tice. 1999. Demographic, clinical, and treatment parameters influencing the outcome of acute cystitis. Clin. Infect. Dis. 29 : 113-119.
11. Fihn, S. D., E. J. Boyko, C. L. Chen, E. H. Normand, P. Yarbro, D. Scholes. 1998. Use of spermicid coated-condoms and other risk factors for urinary tract infection caused by Staphylococcus saprophyticus. 9 : 281-287.
12. Freney, J., F. Renaud, W. Hansen, C. Bollet. 2000. Précis de Bactériologie clinique. Ed. Eska. pp. 783-830.
13. Gatermann, S., B. Kreft, R. Marre, G. Wanner. 1992. Identification and Characterization of a Surface-Associated Protein (Ssp) of Staphylococcus saprophyticus. Infection and Immunity. 60 : 1055-1060.
13. Gatermann, S., H. G. Meyer, G. Wanner. 1992. Staphylococcus saprophyticus Hemagglutinin Is a 160-Kilodalton Surface Polypeptide. Infection and Immunity. 60 : 4127-4132.
15. Gupta, K., D. Scholes, W. E. Stamm. 1999. Increasing prevalence of antimicrobial resistance among uropathogens causing uncomplicated cystitis in women. JAMA. 281 : 736-738.
16. Hajek, V., H. Meugnier, M. Bes, Y. Brun, F. Fiedler, Z. Chmela, Y. Lasne, J. Fleurette, J. Freney. 1996. Staphylococcus saprophyticus subsp. bovis subsp. nov., Isolated from Bovine nostrils. Int. J. Syst. Bacteriol. 46 : 792-796.
17. Hedman, P., O. Ringertz, B. Eriksson, P. Kvarnfors, M. Andersson, L. Bengtsson, K. Olsson. 1990. Staphylococcus saprophyticus found to be a common contaminant of food. J. Infect. 21 : 11-19.
18. Hedman, P., O. Ringertz. 1991. Urinary tract infections caused by Straphylococcus saprophyticus. A matched case control study. J. Infect. 23 : 145-153.
19. Hedman, P., O. Ringertz, M. Lindröm, K. Olsson. 1993. The Origin of Staphylococcus saprophyticus from Cattle and Pigs. Scand. J. Infect. Dis. 25 : 55-60.
20. Heir, E., G. Sundheim, A. L. Holck. 1998. The Staphylococcus qacH gene product : a new member of the SMR family encoding multidrug resistance. FEMS Microbiol. Lett. 163 : 49-56.
21. Hell, W., H. G. Meyer, S. G. Gatermann. 1998. Cloning of aas, a gene encoding a Staphylococcus saprophyticus surface protein with adhesive and autolytic properties. Mol. Microbiol. 29 : 871-881.
22. Hell, W., T. Kern, M. Klouche. 1999. Staphylococcus saprophyticus as an unusual agent of nosocomial pneumonia. Clin. Infect. Dis.. 29 : 685-686.
23. Hofbauer, H., K. G. Naber, M. Kinzig-Schippers, F. Sorgel, C. Rustige-Wiedemann, B. Wiedemann, A. Reiz, M. Kresken. 1997. Urine bactericidal activity of pefloxacin versus norfloxacin in healthy female volunteers after a single 800-mg oral dose. Infection. 25 : 121-126.
24. Hooton, T. M., D. Scholes, A. E. Stapleton, P. L. Roberts, C. Wointers, K. Gupta, M. Samadpour, W. E. Stamm. 2000. N. Engl. J. Med. 343 : 992-997.
25. Hovelius, B., P. A. Märdh. 1977. On the diagnostic of coagulase-negative staphylococci with emphasis on Staphylococcus saprophyticus. Acta Path. Microbiol. Scand. Sect. B. 85 : 427-434.
26. Hovelius, B., P. A. Märdh. 1979. Haemagglutination by Staphylococcus saprophyticus and other staphylococcal species. Acta Path. Microbiol. Scand. Sect. B. 87B : 45-50.
27. Hovelius, B., I. Thelin, P. A. Märdh. 1979. Staphylococcus saprophyticus in the aetiology of nongonococcal urethritis. Brit. J. Vener. Dis. 55 : 369-374.
28. Huwe, P., T. Diener, M. Ludwig, J. Liu, H. G. Schiefer, W. Weidner. 1998. Influence of different uropathogenic microorganisms on human sperm motility parameters in an in vitro experiment. Andrologia. 30 : 55-59.
29. Jackson, E. F. 1985. Staphylococcus saprophyticus as the Cause of Infected Urinary Calculus. Ann. Intern. Med. 102 : 342-343.
30. Jellheden, B., R. S. Norrby, T. Sandberg. 1996. Symptomatic urinary tract infection in women in primary health care. Bacteriological, clinical and diagnostic aspects in relation to host response to infection. Scand. J. Prim. Health Care. 14 : 122-128.
31. Kawano, J., A. Schimizu, Y. Saitoh, M. Yagi, T. Saito, R. Okamoto. 1996. Isolation of methicillin resistant coagulase-negative staphylococci from chickens. J. Clin. Microbiol. 34 : 2072-2077.
32. Kloos, W. E., C. G. George, J. S. Olgiate, L. Van Pelt, M. L. McKinnon, B. L. Zimmer, E. Muller, M. P. Weinstein, S. Mirrett. 1998. Int. J. Syst. Bacteriol. Staphylococcus hominis subsp. novobiosepticus subsp. nov ., a novel trehalose- and N-acetyl-D-glucosamine-negative, novobiocin- and multiple antibiotic-resistant subspecies isolated from human blood. 48 : 799-812.
33. Lambert, L. H., T. Cox, K. Mitchell, R. A. Rossello-Mora, C. Del Cueto, D. E. Dodge, P. Orkand, R. J. Cano. 1998. Staphylococcus succinus sp. nov., isolated from Dominican amber. Int. J. Syst. Bacteriol. 48 : 511-518.
34. Latham, R. H., K. Running, W. E. Stamm. 1983. Urinary Tract Infection in Young Adult Women Caused by Staphylococcus saprophyticus. JAMA. 250 : 3063-3066.
35. Loulergue, J., G. Pinon, P. Laudat, A. Audurier. 1984. Fosfomycin resistance in Staphylococcus saprophyticus and other species of coagulase-negative staphylococci. Ann. Microbiol. 135 : 239-247.
36. Marrie, T., C. Kwan, M. A. Noble, A. West, L. Duffield. 1982. Staphylococcus saprophyticus as a Cause of Urinary Tract Infection. J. Clin. Microbiol. 16 : 427-431.
37. Martineau, F., F. J. Piard, C. Menard, P. H. Roy, M. Ouellette, M. G. Bergeron. 2000. Development of a Rapid PCR Assay Specific for Staphylococcus saprophyticus and Application to Direct Detection from Urine samples. J. Clin. Microbiol. 38 : 3280-3284.
38. Minassian, M. A., D. A. Lewis, D. Chattopadhyay, B. Bovill, G. J. Duckworth, J. D. Williams. 1998. A comparison between single-dose fosfomycin trometamol (Monuril) and a 5-day course of trimethoprim in the treatment of uncomplicated lower urinary tract infection in women. Int. J. Antimicrob. Agents. 10 : 39-47.
39. Modun, B., P. Williams. 1999. The staphylococcal transferrin-binding protein is a cell wall glyceraldehyde-3-phospate deshydrogenase. Infect. Immun. 67 : 1086-1092.
40. Morgan, J. W. 1983. Abbreviated Scheme for Presumptive Identification of Staphylococcus saprophyticus from Urine Cultures. J. Clin. Microbiol. 18 : 1272-1274.
41. Nicolle, L. E. 2000. Asymptomatic Bacteriuria - Important or Not ? New Engl. J. Med.343 : 1037-1039.
42. Nicolle, L. E. 2000. Pivmecillinam in the treatment of urinary tract infections. J. Antimicrob. Chemother. Suppl. A. : 35-39.
43. Parkkari, M., H. Paivarinta, L. Salminen. 1995. The treatment of endophthalmitis after cataract surgery : review of 26 cases. J. Ocul. Pharmacol. Ther. 11 : 349-359.
44. Pead, L., R. Maskell, J. Morris. 1985. Staphylococcus saprophyticus as a urinary pathogen : a six year prospective survey. Brit. Med. J. 291 : 1157-1159.
45. Pereira, A. T., 1962. Coagulase-negative strains of staphylococcus possessing antigen 51 as agents of uriary tract infection. J. Clin. Pathol. 15 : 252-253.
46. Personne, Ph., M. Bes, G. Lina, F. Vandenesch, Y. Brun, J. Etienne. 1997. Comparative Performances of Six Agglutination Kits ssessed by Using Typical an Atypical Strains of Staphylococcus aureus. J. Clin. Microbiol. 35 : 1138-1140.
47. Reuther, J. W. A., W. C. Noble. 1993. An Ecologial Niche for Staphylococcus saprophyticus. Microbial Ecology in Health and Dis. 6 : 209-212.
48. Ringertz, O., J. Torssander. 1986. Prevalence of Staphylococcus saprophyticus in Patients in aVenereal Disease Clinic. Eur. J. Clin. Microbiol. 5 : 358-361.
49. Schleifer, K. H., W. E. Kloos. 1975. Isolation and Characterization of staphylococci from human skin. I. Amended descriptions of Staphylococcus epidermidis and Staphylococcus saprophyticus and description of three new species : Staphylococcus cohnii, Staphylococcus haemolyticus and Staphylococcus xylosus. Int. J. Syst. Bacteriol. 25 : 50-61.
50. Schneider, P. F., T. V. Roley. 1996. Staphylococcus saprophyticus urinary tract infections : epidemiological data from Western Australia. Eur. J. Epidemiol. 12 : 51-54.
51. Singh, V. R., I. Raad. 1990. Fatal Staphylococcus saprophyticus Native Valve Endocarditis in an Intravenous Drug Addict. J. Infect. Dis. 162 : 783-784.
52. Stamm, W. E. 1988. Protocol for diagnosis of urinary tract infection : reconsidering the criterion for significant bacteriuria. Urology. 32 (Suppl.) : 6-12.
53. Stein, G.E., Schooley S., J. McMillan. 1998. Urinary Pharmacodynamics of low-dose ciprofloxacin and ofloxacin. Diagn. Microbiol. Infect. Dis. 30 : 261-265.
54. Teti, G., M. S. Chiofalo, F. Tomasello, C. Fava, P. Mastroeni. 1987. Mediation of Staphylococcus saprophyticus Adherence to Uroepithelial Cells by Lipoteichoic Acid. Infect. Immun. 55 : 839-842.
55. Vernozy, C., C. Mazuy, H. Meugnier, M. Bes, Y. Lasne, F. Fiedler, J. Etienne, J. Freney. 200. Staphylococcus fleurettii sp. Nov., isolated from goat’s milk cheeses. Int. J. Syst Evolution. Microbiol. 50 : 1521-1527.
56. Wallmark, G., I. Arremark, B. Telander. 1978. Staphylococcus saprophyticus : a frequent cause of acute urinary tract infection among female outpatients. J. Infect. Dis. 138 : 791-797.
57. Weiss, K., D. Rouleau, M. Laverdière. 1996. Cystitis due to vancomycin-intermediate Staphylococcus saprophyticus. J. Antimicrob. Chemother. 37 : 139-1040.
Quelques adresses:
http://lyon-sud.univ-lyon1.fr/bacterio-viro/DESLYON/Fiches/chapitre1/Saprophyticus.html
http://www.sfm.asso.fr/nouv/general.php?pa=2
|
|
|
|
|