RICKETTSIA



1 - Introduction
Les rickettsies sont des bactéries à développement intracellulaire obligatoire. De nombreux animaux constituent le réservoir naturel de ces bactéries. L’homme ne représente qu’un hôte accidentel, à l’exception de R. prowazekii (agent du typhus exanthématique) qui est une espèce de réservoir essentiellement humain.
Les rickettsies infectent également de nombreux arthropodes, qui interviennent dans leur cycle infectieux en assurant la transmission inter-humaine, inter-animale ou de l’animal à l’homme de ces bactéries. Il n’y a pas de transmission inter-humaine directe.
| Les rickettsioses sont donc pour la plupart des zoonoses. On en distingue trois grands groupes : - Typhus, comprenant le typhus exanthématique (typhus épidémique à poux ou typhus fever), autrefois à l’origine de pandémies dévastatrices, et le typhus murin (typhus endémique). - Fièvres boutonneuses, très nombreuses. - Typhus des broussailles (scrub typhus) |
 |
2 - Taxonomie et caractéristiques bactériologiques
Les bactéries appartiennent à la famille des Rickettsiaceae, et comprennent deux genres bactériens : Rickettsia qui contient l’ensemble des espèces du groupe typhus et celles du groupe des fièvres boutonneuses, et Orientia avec une seule espèce, O. tsutsugamushi, responsable du typhus des broussailles.
| Groupe typhus | R. prowazekii | typhus exanthématique |
| R. typhi | typhus murin | |
| R. canadensis | Pathogénicité ? |
 |
Le groupe des fièvres boutonneuses comprend 20 espèces reconnues pathogènes chez l’homme. On citera notamment R. rickettsii, responsable de la fièvre pourprée des montagnes rocheuses aux Etats-Unis découverte par T.H. Ricketts en 1906 qui curieusement mourut du typhus en 1910. R. conorii est responsable de la fièvre boutonneuse méditerranéenne, seule rickettsiose autochtone en France. |
- Typhus des broussailles est liée à O. tsutsugamushi.
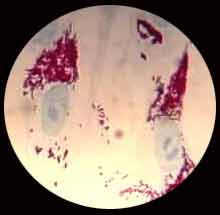
| Ces bactéries sont de petits bacilles intracellulaires (0.3 µm de diamètre x 1 à 2 µm de long), possédant une structure de paroi proche de celle des bactéries à Gram négatif, mais mal ou non colorées par cette technique. Des colorations spécifiques permettent de révéler ces bactéries, notamment la coloration de Gimenez (ci-joint).
|
 |
3 - Epidémiologie
3-1 Groupe typhus
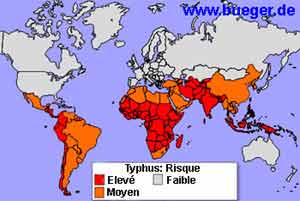
• R. prowazekii est une espèce de réservoir essentiellement humain, même si la bactérie a été récemment isolée chez certains écureuils volants (flying squirrels) aux Etats-Unis. La transmission de la maladie est inter-humaine, par l’intermédiaire d’un vecteur, le pou du corps (Pediculus humanus corporis). R. prowazekii entraîne généralement la mort des poux infectés, qui prennent une coloration rouge après infection.
 |
| Le mode de transmission de la maladie explique sa répartition prédominante dans les pays en voie de développement, où l’infestation par le pou du corps demeure prépondérante. Bien que la maladie soit absente de la plupart des pays industrialisés, il existe un risque potentiel d’acquisition de la maladie dans la population des sans domicile fixe, infestée par le vecteur, à partir d’un cas importé. |
 |
| • R. typhi possède un réservoir animal étendu, représenté essentiellement par de petits rongeurs. L’homme n’est qu’un hôte accidentel. Les rats (Rattus ratus, R. norvegicus) sont habituellement à l’origine des contaminations humaines, par l’intermédiaire d’un vecteur , la puce du rat (Xenopsylla cheopis). Cette maladie est de répartition mondiale, bien que rare dans les pays occidentaux. Elle est détectée principalement dans les zones portuaires. |
 |

Xenopsylla cheopis |
3-2 Groupe des fièvres boutonneuses
Les rickettsioses de ce groupe ont un réservoir animal, à partir duquel l’homme est infecté par l’intermédiaire d’un vecteur arthropode. Leur répartition géographique est étroitement liée à celle de leurs vecteurs respectifs.
|
La plupart de ces rickettsioses sont transmises par l’intermédiaire d’une ou plusieurs espèces de tiques " dures " (Ixodidés), qui présentent une spécificité d’espèce relative: Rhipicephalus sanguineus, la tique du chien, est responsable de la transmission de R. conorii dans le pourtour méditerranéen. |
 |
Rickettsioses en Afrique: http://www.cdc.gov/ncidod/eid/vol7no6/parolaG.htm
| Dermacentor andersoni est la tique responsable de la transmission de la fièvre pourprée des montagnes rocheuses aux Etats Unis. |
 |
Plus rarement, des vecteurs arthropodes non classés parmi les tiques sont en cause. R. akari, responsable d’une fièvre vésiculeuse (" Rickettsialpox ") de répartition limitée (Etats-Unis, Ukraine et Slovénie notamment), est transmise par un acarien des petits rongeurs (Allodermanyssus sanguineus).
Rickettsia felis, espèce de description récente, est transmise à l’homme par la puce du chat (Ctenocephalides felis), cet animal étant réservoir naturel pour cette espèce.

3-3 Typhus des broussailles
|
Le typhus des broussailles est endémique dans l’Est du continent asiatique et dans l’Ouest du Pacifique. La maladie s’observe notamment dans le sud-est asiatique: Japon, Chine, Russie asiatique, Thaïlande, Laos, Cambodge, Malaisie et Australie.
Le réservoir est animal, l’homme n’étant qu’un hôte accidentel. La transmission à l’homme se fait par piqûre de larves de thrombiculidés (Leptotrombidium deliense), vecteurs de la maladie. Ces acariens vivent habituellement en zones broussailleuses (scrub) d’où le nom donné à cette rickettsiose. http://www.afrims.org/afrimsprofile/p25.htm |
|
L’incubation après piqûre de tique (ou autre arthropode vecteur) est en moyenne de 7 jours. Les rickettsioses sont le plus souvent évoquées devant un tableau clinique associant une fièvre d’installation brutale, avec parfois céphalées, arthralgies, myalgies, évoquant un syndrome pseudo-grippal, et l’apparition vers le 5ème jour d’évolution d’une éruption cutanée maculeuse ou maculo-papuleuse d’abord du tronc puis pouvant se généraliser.
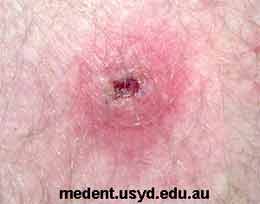 |
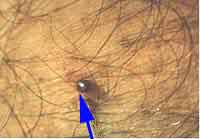
L’association de cette symptomatologie à la découverte d’un escarre cutané d’inoculation et/ou la notion de piqûre d’arthropode (le plus souvent de tique) en zone d’endémie ou au retour d’un séjour en zone d’endémie est caractéristique. Une leucopénie, une élévation des transaminases et une thrombopénie sont fréquemment observées. Les formes les plus sévères sont liées à la vascularite induite par un tropisme des rickettsies pour les cellules endothéliales, cellules cibles dans lesquelles a lieu la multiplication de ces bactéries. |
Le typhus se caractérise par une éruption cutanée très fugace voire absente et la fréquence d’une atteinte neurologique (avec confusion ou tuphos) qui fait toute la gravité de la maladie.
R. prowazekii possède la particularité de pouvoir persister chez les patients infectés, avec la possibilité de résurgences plusieurs années après la primo-infection. Cette résurgence appelée maladie de Brill- Zinsser, correspond en général à un tableau de typhus atténué.
Les fièvres boutonneuses (à gauche) correspondent à la description la plus classique de ces rickettsioses. La fièvre pourprée des montagnes rocheuses est l’affection la plus grave dans ce groupe.
Le typhus des broussailles (à droite) se caractérise aussi par la présence fréquente d’une hépatomégalie, d’une splénomégalie et d’adénopathies multiples.
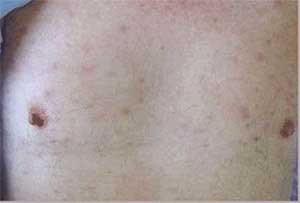
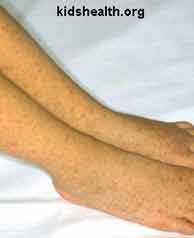
5 - Diagnostic biologique
- Le diagnostic repose surtout sur la sérologie. La détection des anticorps spécifiques est possible en règle générale après 2 à 3 semaines d’évolution de la maladie. Il existe peu de réactions croisées avec des espèces non-rickettsiennes. Le test historique de Weil-Felix utilisait comme antigènes, trois souches de Proteus (P. vulgaris OX2, P. vulgaris OX19 et P. mirabilis OXK) du fait de l’existence de réactions croisées entre ces souches et les différents groupes de rickettsies. La multiplication in vitro des rickettsies en cultures de cellules eucaryotes permet aujourd’hui la préparation de suspensions antigéniques.
|
Il est nécessaire habituellement de tester un antigène pour chacun des trois groupes (typhus, fièvres boutonneuses et typhus des broussailles), en fonction des données épidémiologiques. L’existence de réactions croisées en sérologie entre les différentes espèces de rickettsies empêche habituellement d’établir un diagnostic de l’espèce en cause avec certitude. - Les techniques d’amplification génique (PCR) ont essentiellement un intérêt appliqué à la détection de l’ADN de rickettsies au niveau d’une biopsie d’escarre cutané. Dans ce cas, elles sont très utiles pour établir un diagnostic rapide de rickettsiose: Exemple d'amplification de l'ARNr 16S. |
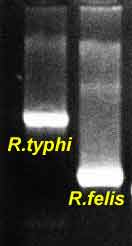 |
 |
- La culture en cellules eucaryotes est possible, notamment à partir de sang ou de biopsies d’escarres cutanées. Ces techniques sont de mise en œuvre difficile et de sensibilité médiocre, ce qui réduit considérablement leur intérêt diagnostique. En pratique, les cultures de rickettsies ne sont réalisées qu’en laboratoire de référence dans un but d’isolement de nouvelles souches. |
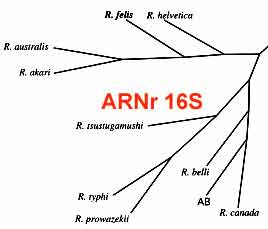 |
- L’identification au niveau de l’espèce a été longtemps réalisée sur des souches isolées par la méthode décrite par Philip en 1978 utilisant une batterie d’anticorps monoclonaux spécifiques d’espèce. Ce test est progressivement remplacé aujourd’hui par amplification et séquençage de gènes de rickettsies tel ARNr 16S.
|
Contacter le CNR si nécessaire: http://ifr48.free.fr/recherche/labo/rickettsies/rickettsies.html
6 - Sensibilité aux antibiotiques
L’évaluation de la sensibilité des rickettsies aux antibiotiques ne se fait pas en routine, car réalisée uniquement en culture cellulaire, généralement en laboratoire de référence.
Les ß- lactamines, les aminoglycosides et le cotrimoxazole sont inactifs.
Seuls les antibiotiques à bonne pénétration intracellulaire sont actifs vis-à-vis des rickettsies: tétracyclines, fluoroquinolones, mais aussi macrolides (josamycine), azalides (azithromycine) et chloramphénicol. Aucune résistance acquise à ces antibiotiques n’a été caractérisée à ce jour.
7- Prophylaxie
|
- Il n’existe pas de vaccin. La prophylaxie la plus efficace repose sur la lutte et la protection vis-à-vis des arthropodes vecteurs. - L’éradication des poux du corps par des mesures d'hygiène (lavage), le changement fréquent des vêtements et éventuellement l’utilisation de poudres acaricides (ex. perméthrine) permet de lutter contre le typhus exanthématique. - La lutte contre la prolifération des rats est efficace contre la propagation du typhus murin. |
 |
- Concernant les rickettsioses éruptives ou fièvres boutonneuses, la protection vis-à-vis des piqûres de tiques, habituellement indolore, est essentielle. Il est nécessaire de rechercher ces acariens au niveau cutané de façon systématique notamment après un séjour en zone fortement infestée.
| La tique ne peut habituellement transmettre les rickettsies qu’après attachement prolongé (plusieurs heures voire plusieurs jours) à son hôte. La protection vis-à-vis des piqûres d’acariens est également essentielle dans la prophylaxie du typhus des broussailles. Une administration prophylactique hebdomadaire de doxycycline est également préconisée en zone de forte endémie. |
 |
|
Ce cours a été préparé par le Professeur M. MAURIN (Faculté de Médecine de Grenoble)(01.11.03) .
http://www.med.sc.edu:85/mayer/ricketsia.htm
http://gsbs.utmb.edu/microbook/ch038.htm
http://www.itg.be/
|
|
|
|
|
 .
.