MYCOBACTERIUM

Avec la lèpre (due à Mycobacterium leprae) et la tuberculose (due à Mycobacterium tuberculosis ou Bacille de Koch), les mycobactéries sont responsables de deux des plus grands fléaux qui ravagent l’humanité depuis des millénaires. Mais si la lèpre est restée une priorité des instances internationales, la résurgence de la tuberculose a remis cette maladie au premier plan de l’actualité. En effet, avec 2 000 000 de morts en 2002 et une propagation rapide à des patients immunodéprimés, principalement dans le tiers-monde, ou socialement marginalisés dans les pays industrialisés, la tuberculose éveille les mêmes craintes qu’au XIXème siècle, d’autant plus que le risque de résistance du bacille aux antituberculeux augmente. Cela justifie la décision prise par les instances sanitaires internationales, en 2000, d’associer la lutte contre la tuberculose à un Fonds Mondial de lutte contre le SIDA et le Paludisme.
A côté de ces fléaux, différentes maladies regroupées sous le terme générique de mycobactérioses ont été rapportées à des mycobactéries dites " atypiques ". Cependant, à quelques exceptions près, ces infections qui diffèrent les unes des autres par l’épidémiologie, la symptomatologie et le traitement restent marginales.
Le principal point commun à toutes ces espèces appartenant au genre Mycobacterium, placé dans l'ordre des Actinomycétales, est une propriété tinctoriale pathognomonique mise en évidence par la coloration de Ziehl-Neelsen: l’acido-alcoolo-résistance.
Cependant ces bactéries peuvent présenter une coloration de Gram "insuffisante" comme dans cette aspiration bronchique:
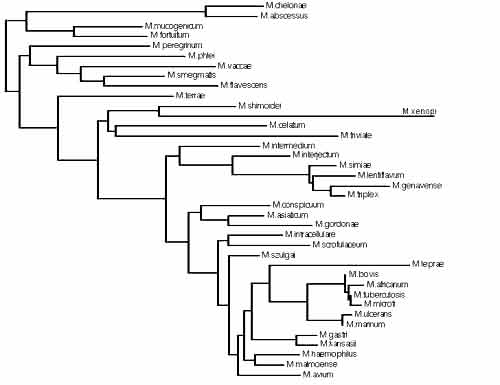
Les mycobactéries constituent maintenant un groupe très complexe en constante évolution:
Diversité du genre Mycobacterium après comparaison des séquences du gène rpoB
2 - Historique
L’ancienneté de la tuberculose est attestée par l’existence de lésions osseuses caractéristiques du mal de Pott, découvertes sur des squelettes très anciens comme certains datés du néolithique ou chez des momies de l’Egypte ancienne. Polichinelle, avec sa bosse, n’est qu’une version moderne de la gibbosité pottique. Les preuves que les anciens connaissaient tant les formes osseuses que viscérales de la tuberculose existent dans l’iconographie et les textes anciens des civilisations méditerranéennes, orientales, extrême-orientales et aussi dans des poteries de l’Amérique précolombienne.
Plus proche de nous, c’est par un privilège de la monarchie française que le roi " guérissait " le jour de son sacre les écrouelles, ou scrofules, c’est-à-dire les adénites cervicales tuberculeuses fistulisées. Enfin, certaines formes de la maladie n’ont été individualisées que tardivement : ainsi la description de la méningite tuberculeuse ne remonte qu’au milieu du XVIIIème siècle.
| La tuberculose est entrée dans l’ère scientifique au début du XIXème siècle grâce à Laennec. Celui-ci découvrit non seulement l’auscultation médiate, mais surtout, il individualisa la tuberculose en tant qu’entité anatomo-clinique ce que confirmera l’histologie, quelques dizaines d’années plus tard. En effet, avant Laennec, les différentes formes de la maladie étaient considérées comme nosologiquement différentes. La transmissibilité de la tuberculose a été démontrée en 1866 par Villemin, déjà défendue par Frascator en Italie au XVIème siècle. |
 |
|
|
Enfin, les progrès décisifs ont découlé des découvertes successives de la nature bactérienne de la tuberculose par Robert Koch en 1882, de la mise au point du BCG en 1921 par Calmette et Guérin, de la découverte de la streptomycine en 1943 par Waksman et, plus récemment, du séquençage complet du génome de M. tuberculosis en 1998.
Quelques images historiques: |
La présence de M. tuberculosis est étroitement liée à la présence humaine. L’excrétion du bacille par le malade explique qu’on puisse l’isoler de façon transitoire dans l’environnement, car il peut survivre au froid et à la dessication. Il est sensible aux agents physiques comme les rayonnements ionisants, les UV et la lumière. Sa sensibilité aux agents chimiques est variable : détruit par l’alcool à 70°, il résiste à de nombreux antiseptiques, aux bases et aux acides dilués. Dans l’environnement familier de l’homme, les petits mammifères et les oiseaux peuvent s’infecter et devenir eux-mêmes vecteurs de la tuberculose, de même que les gros mammifères d’élevage contaminés par l’homme.
4 - Epidémiologie
|
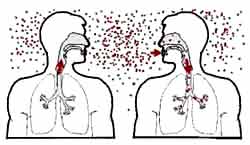
Le Bacille de Koch est un agent pathogène strictement humain dont la forme pulmonaire assure principalement la transmission inter-humaine - gouttelettes de Flügge- à partir des sécrétions bronchiques drainant les lésions pulmonaires cavitaires. Les autres localisations restent closes et ne participent à la transmission du bacille qu’au stade de fistulisation. La transmission alimentaire ne concerne que la tuberculose à M. bovis qui est pratiquement éradiquée dans les pays où le cheptel est contrôlé et le lait pasteurisé. |
Au XXème siècle, les pays développés qui ont pu bénéficier de la mise en place de structures de lutte antituberculeuse avec une prophylaxie par l’hygiène et éventuellement la vaccination, et des traitements antibiotiques succédant aux cures climatiques et aux sanatoriums ont vu les taux d’incidence s’abaisser comme actuellement en France où près de 7 000 nouveaux cas sont déclarés chaque année, soit un peu plus de 10 pour 100 000 habitants.
|
Par contre les pays pauvres, ceux où le SIDA se répand sans contrôle et ceux qui subissent de graves bouleversements sociaux tels certains pays d’Europe de l’Est, d’Afrique, d’Asie et d’Amérique du sud atteignent des taux d’incidence compris entre 50 et 100 pour 100 000 habitants. |
|
La tuberculose est en France une maladie à déclaration obligatoire (MDO n°27): |
La tuberculose en France :
http://www.invs.sante.fr/beh/2002/16_17/
http://www.invs.sante.fr/beh/2003/10_11/index.htm
http://www.ap-hop-paris.fr/actualite/mag_tuberculose2.htm
5 - Pouvoir pathogène
- La terminologie médicale désigne par " tuberculose infection" l’ancienne primo-infection tuberculeuse, par opposition à la " tuberculose maladie ". La tuberculose infection représente la réaction de l’organisme au premier contact avec M. tuberculosis (contage); celle-ci reste le plus souvent asymptomatique et ne concerne pratiquement que le poumon, porte d’entrée principale du germe.
| - Les rares formes symptomatiques (patentes) permettraient éventuellement de retrouver la notion de contage dans l’entourage du patient, le complexe primaire à la radio du thorax (chancre d’inoculation dans le parenchyme pulmonaire et le ganglion satellite) et le virage de l’intradermoréaction à la tuberculine chez les sujets antérieurement connus négatifs. La tuberculose maladie qui représente une manifestation secondaire du bacille, pouvant atteindre n’importe quel organe, survient soit d’un seul tenant après la tuberculose infection dans les formes les plus graves, en particulier chez le nourrisson, soit après une latence qui peut atteindre plusieurs années chez l’adulte et favorisée par la diminution des défenses immunitaires cellulaires. Le poumon représente la principale localisation de la maladie, toujours associée à une atteinte ganglionnaire, alors que l’atteinte pleurale est plus rare. |
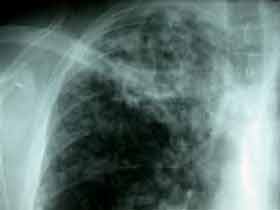 |
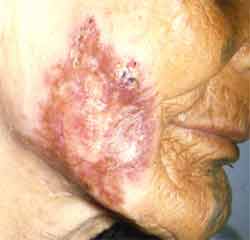 |
Les autres formes sont dix fois moins fréquentes et sont principalement représentées par la miliaire (septicémie tuberculeuse), la méningo-encéphalite, les localisations génito-urinaire, ostéoarticulaire (mal de Pott, coxalgie) et l’adénite cervicale isolée. Il existe cependant beaucoup d’autres localisations plus rares de la tuberculose parmi lesquelles la péricardite, la thyroïdite, l’otite, le tuberculome cérébral ou le lupus cutané tuberculeux. Enfin suite à une vaccination par le BCG, d'exceptionnelles formes cutanées (BCGites) sont rapportées. Quelques formes cutanées : |
6 - Physiopathologie et Phénomène de Koch
- Au stade initial de tuberculose infection à porte d’entrée pulmonaire, M. tuberculosis exprime sa pathogénicité en se multipliant à l’intérieur des macrophages alvéolaires qui l’ont phagocyté : le bacille de Koch est une bactérie pathogène intracellulaire. La réaction locale aboutit en un peu plus d’un mois à une lésion histologique caractéristique: le granulome ou tubercule qui est constitué de cellules épithélioïdes et de cellules géantes multinucléées entourées d’une couronne lymphocytaire et centrées par une zone de nécrose caséeuse. Tout peut s’arrêter à ce stade par un enkystement et une calcification des lésions suivis d’une auto-stérilisation spontanée du chancre d’inoculation. C’est la situation la plus fréquente.
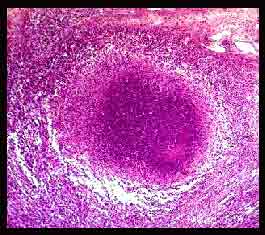
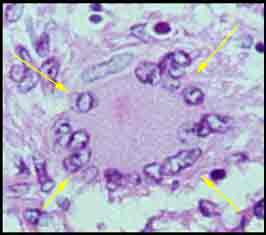
- Parfois, certains macrophages infectés ont pu migrer jusqu’à un ganglion satellite qui empêchera la progression de l’infection et évoluera aussi vers l’auto-stérilisation.
- Plus rarement, si la multiplication bactérienne est importante, le caséum se ramollit, les bacilles débordent les défenses ganglionnaires et disséminent dans l’organisme par voie lymphatique puis sanguine. Le sujet réceptif entre alors dans la tuberculose maladie avec une atteinte préférentielle du poumon isolée ou associée dans les formes graves d’emblée à une miliaire ou encore plus rarement à une méningo-encéphalite. En dehors du poumon, la localisation sera plus souvent limitée à l'appareil génito-urinaire ou ostéo-articulaire par exemple.
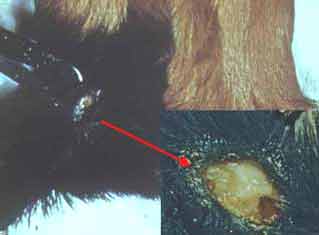
| La maladie expérimentale peut être étudiée chez le cobaye qui y est très sensible et qui développe une tuberculose progressive et mortelle. Deux semaines après l’inoculation sous-cutanée d’une culture apparaît une fistule à bords ulcérés communiquant avec un abcès caséeux au point d’inoculation. Les ganglions loco-régionaux sont simultanément envahis puis la rate et le foie apparaissent hypertrophiés et abcédés. Par cette voie d’inoculation, les poumons ne sont que tardivement et inconstamment atteints. L’animal cachectique meurt en 2 mois. |
 |
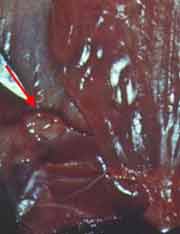 |
|
|
Le phénomène de Koch révèle les modifications survenues dans l’organisme en réponse à l’introduction de M. tuberculosis. D’une part, la réaction locale accélérée correspond à un état d’hypersensibilité de l’organisme vis-à-vis du bacille, en particulier des protéines dont la plus importante est la tuberculine. D’autre part, la résistance à l’infection au point de la seconde inoculation traduit un état d’immunité antituberculeuse acquise : l’immunité de surinfection. Celle-ci a un support cellulaire et non humoral et est à la base de la vaccination antituberculeuse par le BCG. |
 |
7 - Diagnostic biologique
|
Compte tenu des caractères spécifiques de ces germes (coloration, culture) dont ceux du bacille tuberculeux, la recherche doit être précisée sur la demande d'examen. |
7 - 1 Le diagnostic direct consistant à isoler, identifier et tester la sensibilité aux antituberculeux de la souche provenant d’un malade, permet aussi, quand cela s’avère utile, de soumettre la souche à des comparaisons épidémiologiques. C’est dire l’intérêt qu’il y a d’isoler la souche de M. tuberculosis du malade, au besoin en multipliant les prélèvements comme dans la tuberculose pulmonaire, avant tout traitement.
Prélèvements : ceux-ci dépendent de la forme clinique de la maladie.
- Dans la forme pulmonaire : l’expectoration matinale qui ramène des sécrétions bronchopulmonaires purulentes est satisfaisante si le malade crache, sinon l’aspiration par tubage, au réveil, du contenu gastrique, recueille les mucosités dégluties inconsciemment la nuit. Ces prélèvements répétés 3 jours de suite conviennent au diagnostic dans la majorité des cas. Si un examen fibroscopique s’avère nécessaire, l’aspiration du mucopus peut être utile. Par contre, si le lavage broncho-alvéolaire permet aussi cette recherche, il n’a pas d’indication spécifique dans la tuberculose.
- Dans la forme génito-urinaire chez l’homme, le recueil d’un volume d’urines suffisant le matin, 3 jours de suite, est indispensable. La spermoculture peut être entreprise si nécessaire.
- Les autres formes de tuberculose pourront être diagnostiquées par ponction : pleurésie, méningite, arthrite, abcès, ou par différentes biopsies : osseuse, disco-vertébrale, hépatique, endomètre. L’hémoculture ne doit avoir que des indications exceptionnelles.
|
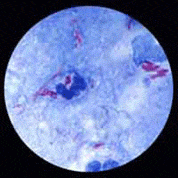
Examen microscopique : la recherche directe de M. tuberculosis est favorisée par la propriété d’acido-alcoolo-résistance du genre Mycobacterium. Cette propriété purement tinctoriale (sans rapport avec la vitalité du germe) est à la base des colorations spécifiques de Ziehl-Neelsen (bacille coloré par la fuschine) et de fluorescence (bacille coloré par l’auramine). Mais cette propriété est commune à toutes les mycobactéries ce qui ne permet pas de conclure sur l’identité de l’espèce observée à ce stade de l’examen. |
 |
|
La positivité de l’examen direct est exprimée en nombre de Bacilles acido-alcoolo-résistants (BAAR) par champ ou sur la lame. Dans la tuberculose pulmonaire, elle signe la plus grande contagiosité de la maladie et correspond à l’ancienne dénomination de bacilloscopie positive. L'acido-résistance relative des mycobactéries est liée à la richesse en lipides de leur paroi dont les cires, en particulier l'acide mycolique lié au peptidoglycane. Elles sont impliquées dans la formation du "granulome" qui représente la lésion histopathologique pathognomonique de la tuberculose. |
 |
C'est la raison pour laquelle diverses méthodes de diagnostic moléculaire direct tentent d'améliorer le rendement et la précision de ce dépistage précose, car, en cas de positivité, il présente l'avantage de permettre l'identification de M. tuberculosis.
|
7 - 2 La culture:
- Les sécrétions respiratoires et les urines ainsi que d'autres prélèvements éventuellement contaminés par une flore bactérienne doivent être décontaminés avant d'être ensemencés dans les milieux riches et rendus sélectifs pour les mycobactéries. |
 |
 |
Par contre, les ponctions et les prélèvements a priori mono-microbiens peuvent être ensemencés tels quels. cf GBEA.
- Les milieux:
| * Les milieux solides sélectifs à l'oeuf coagulé de Loewenstein-Jensen et de Coletsos définissent les caractères culturaux classiques de M. tuberculosis: colonies rugueuses de couleur chamois apparaissant sous l'aspect de "verrue" ou de "chou-fleur" en 3 semaines environ après incubation à 37°C en atmosphère ambiante.
|
 |
 |
* Les milieux liquides permettent de réduire les délais de positivité à quelques jours pour les prélèvements très riches en bacilles et à un peu plus de 2 semaines en moyenne pour ceux paucibacillaires. Ces milieux permettent une détection plus sensible et automatisée.

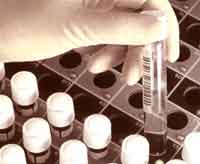
| En milieu liquide, M. tuberculosis apparait sous la forme de longues "cordes" mises en évidence par la coloration de Ziehl-Nelseen. Ce mode de groupement des bacilles est attribué à la production d'une substance particulière appelée "cord factor". |
 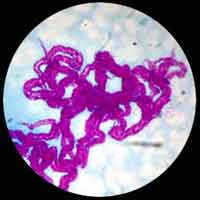 |
- D'autres milieux liquides sont proposés tel MB REDOX® avec une détection visuelle, donc macroscopique:

7-3 L'identification classique de M. tuberculosis à partir de cultures repose sur la morphologie des colonies, sur des propriétés physiologiques telle la production d'acide nicotinique et sur l'effet d'antibiotiques (bactériostase) comme l'acide para-amino-salicylique.
7-4 Aspects moléculaires: L'identification moléculaire est devenue la méthode privilégiée. Elle repose sur la caractérisation de séquences d'acides nucléiques amplifiées puis hybridées à l'aide de sondes (technique GeneProbe®, technique Innolipa®).
|
Technique GenProbe®
|
Technique Innolipa®
|
 |
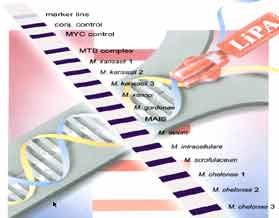 |
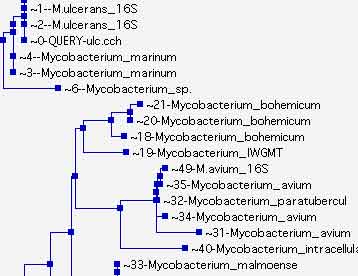
- L'apport du typage moléculaire peut être très utile dans l'investigation de certaines épidémies : http://www.invs.sante.fr/beh/2002/16_17/
http://www.cdc.gov/ncidod/eid/vol7no5/van_crevel.htm
7-5 Diagnostic différentiel de la tuberculose pulmonaire: à ce stade du diagnostic, deux autres espèces , M. africanum et M. bovis, peuvent être identifiées. Morphologiquement, ces BAAR sont de fins bacilles, immobiles, non sporulés, non capsulés comme M. tuberculosis. En culture aérobie sur milieux solides, ils poussent en 6 semaines et se distinguent par l'aspect de leurs colonies:
M. africanum a des colonies rugueuses mais plates
M. bovis montre de petites colonies non pigmentées et lisses qui ne grossissent pas.
Si la pathologie et l'épidémiologie de M. africanum sont similaires à celles de M. tuberculosis, celles-ci sont différentes pour M. bovis: L'infection humaine résulte d'une contamination alimentaire (lait bovin) et montre souvent des localisations extrapulmonaires (osseuses et ganglionnaires, en particulier).
7 - 6 Le diagnostic indirect :
- Il n'existe pas de diagnostic sérologique fiable de la tuberculose, même si des tests sont régulièrement proposés.
|
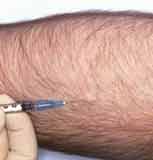
- L'intérêt de la recherche d'une hypersensibilité retardée par intradermoréaction (IDR) ne se dément pas. Le test consiste à injecter 10 UI de tuberculine par voie strictement intradermique sous un volume de 0,1 ml. Le résultat est lu par mesure du diamètre d'induration au point d'injection à la 72 ème heure. Trois situations peuvent se présenter de signification clinique variable : |
 |
|
Diamètre mesuré (mm)
|
Signification clinique
|
|
< 5
|
absence
|
|
entre 5 et 10
|
réaction non spécifique ou vaccination par le BCG |
|
> 10
|
témoigne d'une infection d'autant que la réaction est phlycténulaire |
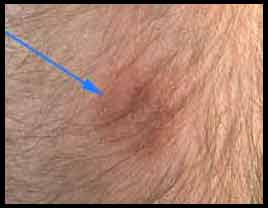
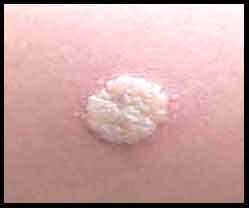
- Lors d'immunodépression, l'interprétation est plus nuancée: ainsi lors de profonde immunodépression, un diamètre de 5 mm peut signifier l'infection. En France, l'interférence avec la vaccination par le BCG complique l'interprétation mais dans les pays ne vaccinant pas par le BCG, l'IDR est un moyen diagnostic essentiel, sensible et spécifique. La positivation d'une IDR, antérieurement négative, définit la primoinfection tuberculeuse.
- Il est admis actuellement qu'il n'existe pas de relation entre la protection contre la tuberculose et la présence d'une hypersensibilité. Ce fait retire toute signification à la pratique de l'IDR pour vérifier la présence de l'hypersensibilité induite par le vaccin BCG. Ainsi les contrôles pratiqués autrefois après vaccination sont-ils supprimés.
8 - Sensibilité aux antibiotiques - traitement
Un antibiogramme est systématiquement entrepris dès l'isolement de la souche et seront systématiquement testés 5 antituberculeux: isoniazide (INH), streptomycine, ethambutol, rifampicine et pyrazinamide.
- Plusieurs techniques existent reposant sur la méthode des proportions telle que la technique en milieu solide (délai de 3 semaines au minimum) ou en milieu liquide (délai plus court de 8 -10 jours)(cf GBEA). Aussi, le traitement (polychimiothérapie) est-il entrepris sans attendre.
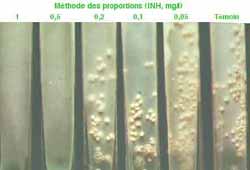
Méthode des proportions en milieu liquide
- La résistance acquise est un mécanisme chromosomique, donc non transmissible par des plasmides aussi la multirésistance de M. tuberculosis reste un problème marginal en France. L'explication de la rareté de ces souches résulte du strict respect de la quadrithérapie en cas de suspicion de résistance initiale ou primaire lors de la mise en oeuvre du traitement.
Place de la résistance primaire et secondaire en France en 1999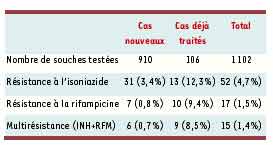
http://www.medecinesciences.org/archive/ms/2003/11/71894-1146-1151.pdf
* En France, la résistance primaire vis-à-vis de la rifampicine se situe autour 0,6% des souches, de façon stable. La caractérisation moléculaire rapide est possible (PCR, séquençage).
* La résistance à l'éthambutol et au pyrazinamide est aussi rare. Enfin la fréquence de résistance à l'INH et à la streptomycine ne dépasse pas 5%.
* En raison de son importance thérapeutique, la multirésistance rifampicine-INH est très étroitement surveillée.
* D'autres antituberculeux comme la clarithromycine, la rifabutine, l'amikacine, les fluoroquinolones, surtout utilisées dans le traitement d'infections à mycobactéries atypiques peuvent être étudiés vis-à-vis de souches de M. tuberculosis multirésistantes.
8 - Prophylaxie
Chez l'homme
|
- La seule prophylaxie vaccinale éprouvée est réprésentée par le BCG. Ce vaccin vivant est une souche de M. bovis atténuée par un grand nombre de repiquages sur milieu bilié et glycériné par Calmette et Guérin. La souche, bien que de faible virulence, conserve son pouvoir de multiplication qui en contre-indique l'emploi en cas de profonde immuno-dépression. |
 |
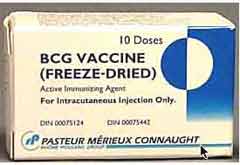 |
Les modalités d'emploi de ce vaccin dans la population dépend de l'endémicité de la maladie. Ainsi la France a rejoint progressivement les pays de faible endémicité ce qui a conduit à réviser sa politique vaccinale d'autant que le principal effet de ce vaccin est la réduction, voire la disparition de la méningite tuberculeuse du nourrisson. Ainsi serait maintenue la vaccination des nourrissons et la revaccination ne serait maintenue que pour des populations définies comme à risque sur des critèes sociologiques et professionnels. |
- La chimioprophylaxie des sujets contacts et de la primo-infection repose sur la bithérapie INH-rifampicine pour une durée non consensuelle de 3 à 6 mois.
Chez l'animal
 |
La prophylaxie peut être offensive consistant au dépistage, puis à l'abattage de certaines animaux domestiques. |
Pour en savoir plus sur la tuberculose en France:
http://textbookofbacteriology.net/tuberculosis.html
http://www.invs.sante.fr/beh/1997/97janvier/
http://www.invs.sante.fr/beh/2002/16_17/
http://www.invs.sante.fr/beh/2003/10_11/index.htm
http://www.bioforma.net/ (cahier de formation N° 29, en cours)
http://www.medecinesciences.org/archive/ms/2003/11/71894-1146-1151.pdf
http://pathology.mc.duke.edu/neuropath/CNSlecture2/CNSlecture2.htm
9- M. leprae
| La lèpre sévit principalement dans les pays du tiers monde situés en zone intertropicale. La lenteur de son développement et sa faible contagiosité ont longtemps masqué son caractère transmissible (maladie à déclaration obligatoire MDO n°17 http://www.invs.sante.fr/surveillance/mdo/dispositif.htm)
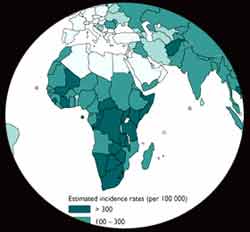
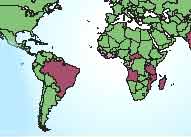
Elle est due à M. leprae (bacille découvert par Hansen en 1873), bactérie dont la culture reste impossible actuellement sur milieux inertes. A droite: distribution globale: http://www.who.int/tdr/dw/leprosy2003.htm |
 |
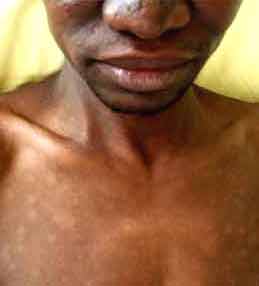
La maladie se caractérise par une atteinte cutanée et nerveuse dont l’expression dépend de la forme et de l’évolutivité de la lèpre. La lèpre tuberculoïde présente des taches cutanées et des troubles névritiques avec épaississement des trajets des nerfs périphériques. Cette forme peu contagieuse et moins évolutive se caractérise histologiquement par un infiltrat épithélioïde et gigantocellulaire. Ce stade peu bacillaire ne se prête pas à un diagnostic bactériologique.
 |
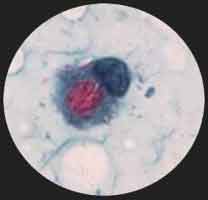 |
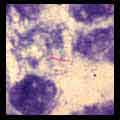
- Au contraire, la lèpre lépromateuse qui est très contagieuse montre des atteintes cutanéo-muqueuses avec des papules apigmentées ou érythémateuses avec une infiltration des tissus caractérisée au visage par le faciès léonin. Les troubles trophiques entraînent progressivement une atrophie musculaire et une lyse osseuse des extrémités conduisant à des mutilations spontanées. La présence de la cellule de Virchow caractérise la lésion histologique de cette forme clinique. La présence d’une rhinite permet de confirmer bactériologiquement le diagnostic par la coloration de Ziehl d’un frottis de la cloison nasale : ce frottis montre quelques cellules mononuclées renfermant des globi qui sont de petits amas arrondis de bacilles intracellulaires prenant la coloration de Ziehl-Nelseen.
Le stade et l’évolution conditionnent le résultat de la chimiothérapie. Avec les sulfones qui ont représenté les premiers anti-lépreux, la rifampicine et la clofazimine permettent d’obtenir la stérilisation des lésions.
Pour en savoir plus:
http://www.who.int/lep/
http://www.invs.sante.fr/beh/1999/9944/
http://www.atlas-dermato.org/atlas/lepreico.htm
http://medecinetropicale.free.fr/lepre.html
http://www.bmc.nc/web_25/page23.html
http://www.ordredemaltefrance.org/soigner.html
http://www.raoul-follereau.org/index.php
10 - Mycobactéries atypiques
| Sur le plan bactériologique, les mycobactéries atypiques se distinguent de M. tuberculosis par l’aspect des colonies, par la pigmentation, par la vitesse de croissance et par les propriétés biochimiques. A droite: Divers aspects culturaux sur le milieu de Loewenstein-Jensen et après des temps d'incubation variable. |
 |
Sur le plan de la pathologie, certaines espèces comme M. kansasii se rapprochent de M. tuberculosis par leur tropisme respiratoire et le traitement comparable à celui de la tuberculose. D’autres comme M. xenopi qui colonise d’anciennes lésions tuberculeuses, ou les mycobactéries du complexe avium-intracellulaire (MAIC) ou M. abscessus qui sont favorisées par l’existence de bronchectasies ou par la mucoviscidose sont peu sensibles à la chimiothérapie.
Au stade de SIDA, l’infection disséminée par MAIC est mise en évidence par hémoculture dans des milieux spécifiques des mycobactéries. Le traitement par la clarithromycine et l’amikacine est moins efficace que l’effet des antirétroviraux combinés sur l’immunodépression.
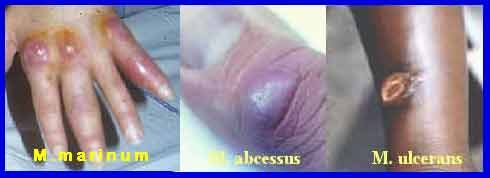
Enfin, beaucoup d’espèces sont responsables d’infections sous-cutanées comme M. fortuitum, M. chelonae qui sont des espèces ubiquitaires à croissance rapide. D’autres sont transmises par l’eau de baignade ou d’aquariums comme M. marinum. En milieu tropical, M. ulcerans est responsable d’une maladie toxique grave : l’ulcère de Buruli, leur traitement médico-chirurgical est long et difficile.
D’autre part, des épidémies d’infections nosocomiales généralement liées à des antiseptiques ou à de mauvaises stérilisations de matériel ont été rapportées pour M. fortuitum, M. kansasii ou M. xenopi.
Pour en savoir plus:
http://tray.dermatology.uiowa.edu/MMarin01.htm M. marinum
http://dermatology.cdlib.org/DOJvol8num2/case_reports/BCG/Torres.html bcgite
http://www.afids.org/case9A.htm M. abcessum
http://www.aquatouch.com/Granuloma.htm M. marinum
http://www.invs.sante.fr/beh/2003/44/ M. marinum
http://www.invs.sante.fr/beh/2000/0017/ M. xenopi
http://www.pasteur.fr/recherche/unites/Lgmb/mycogenomics.html# M. ulcerans
http://www.who.int/gtb-buruli/whatis/index.htm M. ulcerans
http://path.upmc.edu/cases/case124/dx.html M. szulgai
http://tray.dermatology.uiowa.edu/DIB/MFortuit-01.htm M. fortuitum
http://info.med.yale.edu/labmed/casestudies/casestudy1/casestudy1l.html M. avium-intracellulare
Ce cours a été préparé par le Dr G. PAUL (Faculté de Médecine COCHIN-PORT-ROYAL, Université PARIS V)(28.02.04).
|
|
|
|
|