| Objectifs : Connaitre les méthodes et leurs principales étapes du diagnostic biologique d'une infection bactérienne |
A - GÉNÉRALITÉS
Le diagnostic bactériologique est un ensemble de moyens permettant de confirmer telle ou telle étiologie infectieuse d'orIgine bactérienne. Ces moyens diagnostiques sont variés et caractérisent soit le diagnostic direct soit celui indirect :
Le diagnostic direct est le seul diagnostic de certitude, car il permet la mise en évidence de la bactérie elle-même, donc finalement sa culture ou isolement qui permettra l'identification ultérieure mais aussi de préciser sa sensibilité aux antibiotiques (antibiogramme).
L'examen cyto-bactériologique d'un produit pathologique débute par l'examen macroscopique, puis l'examen microscopique (cf diagnostic I). Simultanément cet examen microscopique, est ensemencé le produit pathologique pour l'éventuel isolement d'un ou plusieurs germes.
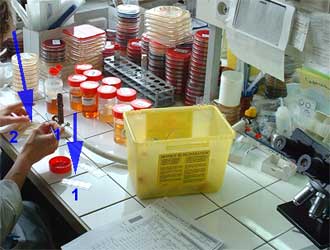
Culture - Isolement :
Divers milieux sont utilisés qui doivent satisfaire les besoins nutritifs et énergétiques des bactéries à cultiver (cf Physiologie-Croissance). En pratique, sont utilisés plusieurs milieux solides (gélosés) avec une technique particulière d'ensemencement (isolement orthogonal ou en cadran) permettant l'isolement de clones bactériens sous la forme de colonies (de l'ordre de 106 bactéries).
Exemples de milieux solides coulés en boite de Pétri selon le produit pathologique et la demande :
- Pus, liquides de ponction : milieux enrichis au sang (frais, cuit=chocolat), milieu sélectif (Chapman, ou sur demande: Loewenstein-Jensen)
- Expectoration : milieux enrichis au sang (frais, cuit), milieu sélectif (Chapman; Drigalski ou sur demande: Lowenstein-Jensen)
- Urines : milieu sélectif (Drigalski), milieu polyvalent pour bactéries G+ et G- (CPS, Uricult®, Chromagar®...).
- Selles (coproculture): milieux sélectifs (Drigalski et SS pour entérobactéries telles Salmonella et Shigella, milieux spéciaux pour Campylobacter (non montré), quelquefois Chapman pour staphylocoque)



Exemples de milieux liquides (cf glossaire) :
L'usage de milieux liquides est limité en raison de l'absence possible d'isolement.
- Sang, pus, liquides de ponction : milieux enrichis (flacons pour hémoculture, coeur-cervelle, trypticase.....
- Selles (coproculture): milieu sélectif (Muller-Kauffman)

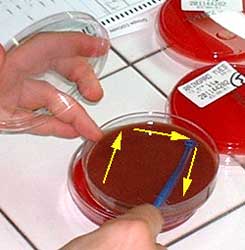
Conclusion : après ensemencement, les divers milieux sont habituellement incubés dans une étuve ou une chambre chaude à 37°C, en atmosphère ambiante (culture aérobie) ou en l'absence d'oxygène (culture anaérobie en jarre plastique, par exemple).


Délai d'incubation : De très nombreuses espèces bactériennes cultivent après 18 à 24 H d'incubation à 37°C. Cependant d'autres espèces ont des délais d'incubation plus longs telles Mycobacterium tuberculosis (temps moyen d'isolement de l'ordre de 21 jours)
Outre le délai d'obtention, les cultures sont examinées en notant la quantité de colonies obtenues de manière :
- semi-quantitative (rares, peu nombreuses, nombreuses, très nombreuses) pour les liquides de ponction, par exemple
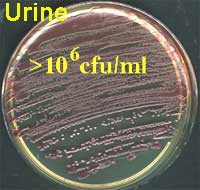
- quantitative (104, 105, 106 ..../ml) pour les prélèvements urinaires et pulmonaires.
Les autres éléments pris en compte sont :
- la culture en aérobiose et/ou en anérobiose
- l'aspect des colonies: la taille, la bordure (lisse, rugueuse), la coloration (pigment jaune pour Staphylococcus aureus, pigment violet pour Serratia marcescens)
- la présence d'une hémolyse (alpha, béta).
Exemples d'isolement:
|
Pus sur une gélose au sang frais
|
Urine sur le milieu CPS
|
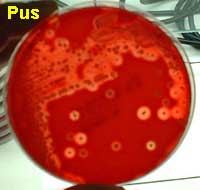 |
 |
Quelques autres exemples de cultures
|
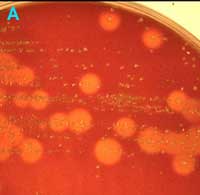
A
Prélèvement de gorge avec de nombreuses colonies ß-hémolytiques (gélose au sang frais) |
B
Expectoration avec de nombreuses colonies soit alpha-hémolytiques et muqueuses évoquant un pneumocoque, soit petites et brillantes évoquant une souche de Haemophilus influenzae (gélose au sang cuit ou gélose chocolat) |
 |
 |
|
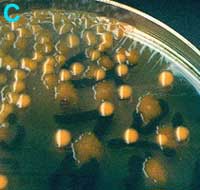
C
Urine avec de nombreuses colonies de deux types d'entérobactéries lactose + (milieu de Drigalski): colonies muqueuses et colonies irrégulières |
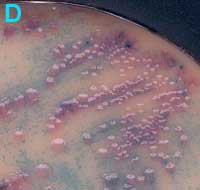
D
Urine avec de nombreuses colonies de trois types différents (milieu UTI) |
 |
 |
Identification - Antibiogramme : L'identification et l'antibiogramme de la majorité des bactéries habituelles est alors précisé dans un délai de 18-24 h.
- A l'aide de tests d'orientation rapide : oxydase, catalase, coagulase...
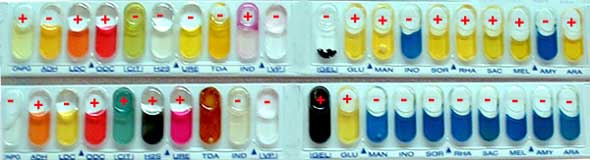
- Par ensemencement d'une galerie biochimique adaptée :
Identification de Escherichia coli et Proteus mirabilis par un ensemble de réactions du métabolisme intermédiaire avec la galerie commerciale API20E (cf Physiologie-Croissance)
Exemple d'un antibiogramme (méthode de diffusion ou des disques) d'une souche de Escherichia coli productrice d'une pénicillinase (cf cours sur les Antibiotiques).

Recherches complémentaires : il peut être nécessaire de déterminer la structure antigénique par des réactions d'agglutination sur lame à l'aide d'immunsérums (cf streptocoques, entérobactéries, Salmonella).
Conclusion : L'étape de l'identification et de l'antibiogramme requiert souvent un délai supplémentaire d'incubation de 24 h. A l'heure actuelle, existent des automates qui effectuent dans un délai de quelques heures, l'identification et l'antibiogramme.


Quelquefois cette procédure est insuffisante pour l'identification d'une bactérie. Il convient de faire appel :
- soit à des modalités classiques de recherche d'autres caractères bactériens tels la croissance sur certains milieux pour l'identification des sources de carbone permettant la croissance (galerie API biotype 100), le type respiratoire, le type fermentaire, le type antigénique, le lysotype......... (cf glossaire)
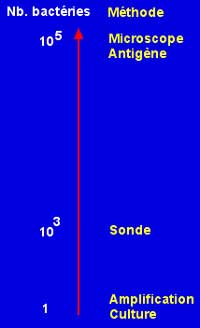
- soit à des modalités modernes telles l'amplification génique (voir ci-dessous) de certains gènes ou encore le séquencage d'autres(ARNr 16S, sodA, gyrB...)(cf séquencage).
Autres moyens diagnostiques (produits bactériens) :
- Recherche d'antigène soluble : Exemple d'une pneumopathie à Legionella pneumophila de sérogroupe L1 ( cf Legionella).
Ce test immunochromatographique sur membrane aide au diagnostic présomptif des infections à Legionella en parallèle avec la culture ou d'autres tests. Les avantages de ce test sont : précocité (dès le début des signes), simplicité (sur urine), rapidité (en + 15 minutes), diagnostic tardif (> 2 mois après les signes cliniques), même après untraitement antibiotique adapté, Donc Bonne valeur prédictive mais ce test ne détecte pas les autres sérogroupes de L. pneumophila, (cf Legionella)

- Méthodes moléculaires : Il existe depuis quelques années, des méthodes pour identifier une bactérie dans un produit pathologique ou d'une culture. Le principe en est simple puisqu'il consiste à amplifier un gène entier ou non avec des amorces spécifiques (cf PCR) qui peut être ultérieurement révêlé par électrophorèse sur gel, ou par hybridation (cf hybridation) ou encore séquencé et comparé avec ceux déposés dans des banques (EMBL, NCBI par exemple)(cf séquencage).
L'intérêt de ces diverses méthodes se résume
d'une part par un bénéfice clinique lié :
- gain de sensibilité (X 2 par rapport aux méthodes classiques) pour la recherche notamment des Chlamydia génitaux.
- gain de temps important (divisé par 2) pour l'identification des mycobactéries à partir de la culture.
- gain de spécificité pour l'identification des germes inhabituels à partir des cultures.
d'une part à la simplicité et la rapidité d'exécution de la plupart de ces techniques ainsi que par leur coût modéré justifiant une utilisation de plus en plus routinière dans les laboratoires de biologie.
Exemples de techniques de Biologie moléculaire:
- PCR : "Polymerase chain reaction" ou l'amplification génique dont le principe est bien connu (cf PCR) est couramment utilisée pour le diagnostic à partir du produit pathologique de germes de culture difficile, voire impossible, tel Chlamydia trachomatis (1 er jet d'urine)
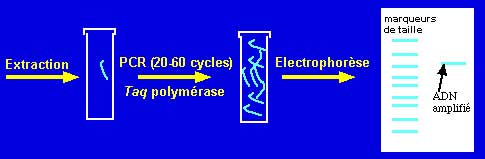
Un appareil de PCR et la révêlation UV d'un produit amplifié après électrophorèse sur gel


- Hybridation : le produit ou ADN amplifié par PCR peut être hybridé avec une sonde spécifique déposée sur un support de type nitrate de cellulose, puis révélé.
Exemple de l'identification d'une espèce de mycobactérie avec le réactif Inno-Lipa®

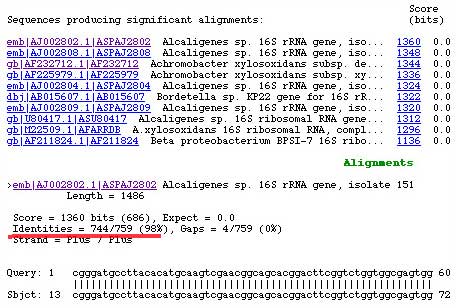
- Séquencage : Certains gènes tels celui codant pour l'ARNr 16S ou 23S peuvent être maintenant amplifiés, séquencés et analysés par comparaison avec ceux déposés dans les banques de données (http://www.infobiogen.......):
Le produit d'amplification (de 400 à 750 bp/brin) a été purifié ou non puis adressé au centre de séquencage. La séquence est alors en quelques jours par courriel (E-mail) puis analysée : GGGGACGTATTCACCGTGCACATTCTGATTCACGATTACTAGCGATTCCGACTTCACGCAGTCGAGTT
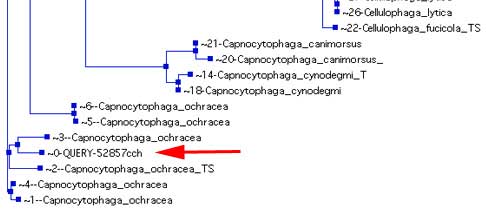
De nouveaux serveurs permettent maintenant des analyses phylogénétiques, devenues nécessaires (Université Lyon 1, BIBI).
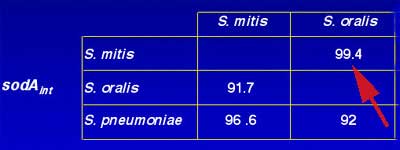
Pour quelques groupes bactériens tels les streptocoques, il est impossible d'établir une différence suffisante dans la séquence de l'ARNr 16S. Aussi sera -t-il fait appel à celle d 'un autre gène comme SodA (Poyart C. et al. Faculté de Médecine Necker-Enfants Malades).
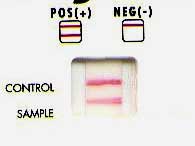
C - DIAGNOSTIC INDIRECT OU SÉROLOGIQUE
Principe : Il se base sur les conséquences induites chez l'hôte (réaction immunologique), à savoir la production d'anticorps (cf cours d'immunologie). La réaction immunitaire ne se développe qu'à partir d'un délai, de l'ordre de 8 à 10 jours. Par ailleurs la spécificité est relative (réactions croisées). La sensibilité varie selon le type de technique utilisée: agglutination et ELISA. De plus, en raison d'immunisation active au cours de la vie, il conviendra de demander deux examens sérologiques à deux semaines d'intervalle. Dans d'autres diagnostics, pourront être individualisés les anticorps anti-M et anti-G.
Techniques : Les anticorps sont recherchés, le plus souvent, dans le sang circulant après prise de sang, de l'ordre de 5 à 10 ml sur tube sec sans anti-coagulant. Il existe diverses techniques pour déceler la présence d'anticorps.
- Réaction d'agglutination
en tubes (sérodiagnostic de Widal-Felix, Wright....) avec des dilutions du sérum (Wright du 1/10 au 1/1280e)


| sur lame (Epreuve à l'antigène tamponné ou rose bengale test dans la brucellose) sur sérum non dilué |
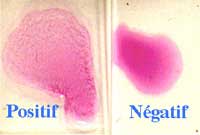
- Réaction de déviation ou fixation du complément
- Recherche d'anticorps par ELISA
- Recherche d'anticorps par immunofluorescence
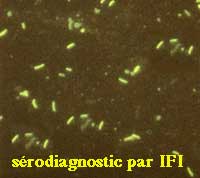
- Recherche d'anticorps par une technique sandwich (Coombs)
- Recherche d'anticorps par une technique de révêlation utilisant les globules rouges
Dosage des anti-Streptolysines O ou ASLO (infections streptococciques)

Dosage des anti-Staphylolysines (infections profondes staphyloccocciques)

Quelques exemples de sérodiagnostic:
Brucellose : agglutination (Wright), Antigène tamponné ou Rose bengale, Fixation du complément, Coombs, IFI, ELISA
Chlamydioses : IFI, Fixation du complément
Legionellose : IFI, ELISA
Lyme (maladie) : IFI, ELISA, Western-blot
Mycoplasmes : Fixation du complément, ELISA
Rickettsioses - Coxiella : IFI
Salmonelloses : anti-typhoparathyphoïdiques (Widal-Félix)
Infections profondes à Staphylocoques : anti-staphylolysines alpha
Infections à Streptocoques du groupe A : anti-streptolysines, anti-strepdornases, anti-streptokinases
Syphilis : TPHA, FTA, TPI, ELISA
Yersiniose à Yersinia enterocolitica : agglutination
Tularémie : agglutination
D - CONCLUSIONS
La décennie écoulée a vu des modifications profondes sur la stratégie diagnostique des infections bactériennes au profit du diagnostic direct ou bactériologique avec un raccourcissement considérable des réponsesà destination des cliniciens. C'est ainsi qu'avec l'avénement des automates d'hémoculture, le délai d'incubation a été raccourci à 5, voire 3 jours pour les germes habituels. A partir du moment où le germe est isolé, il est possible d'obtenir son identification (biochimique) et sa sensibilité aux antibiotiques en quelques heures avec certaines méthodes.
Un autre aspect encourageant des progrès accomplis est sans conteste, l'approche moléculaire avec l'amplification génique (PCR) et le séquencage de certains gènes (celui codant pour l'ARNr 16S, par exemple). D'autres progrès essentiels sont à attendre dans ce domaine, en particulier pour les diagnostics directement sur produits pathologiques. Enfin, on notera une régression des méthodes de diagnostics indirects ou de la place du sérodiagnostic dans la démarche diagnostique en raison de la mauvaise précosité liée au décalage de la réponse de l'organisme à l'infection, de la faible spécificité de la réponse et enfin du caractère transitoire de cette réponse immunologique de l'organisme à l'infection.
Ce cours a été préparé par le Professeur A. PHILIPPON et le Dr. L. PROTS (Faculté de Médecine COCHIN-PORT-ROYAL, Université PARIS V)
|
|
|
|
|