COXIELLA


1 - Introduction
|
Coxiella burnetii est une bactérie à développement intracellulaire obligatoire, responsable de la fièvre Q (" Query fever, puis Q fever", nom attribué par Ted Derrick, médecin australien qui a, le premier, décrit la maladie). |
 |
2 - Taxonomie et caractéristiques bactériologiques
|
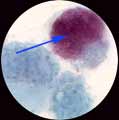
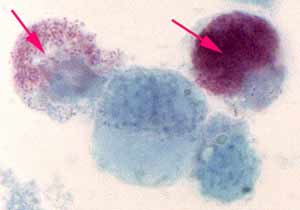
Unique espèce de ce genre, sur le plan phylogénique, C. burnetii est plus proche du genre Legionella que de Rickettsia. C. burnetii (en rouge) à l’intérieur |
 |
Cette bactérie à développement intracellulaire obligatoire nécessite pour sa multiplication in vitro l'utilisation de cultures cellulaires d'eucaryotes. Les bactéries se multiplient à l’intérieur d’une vacuole phagolysosomiale acide. In vivo, la cellule cible principale est le monocyte- macrophage. Toutefois, C. burnetii est très résistante dans le milieu extérieur. Un cycle infectieux évoquant la possibilité d’une sporulation a été décrit et pourrait rendre compte de cette résistance.
C. burnetii présente une variation de phase correspondant à une variation au niveau de son lipopolysaccharide (LPS). La phase I est la phase naturelle retrouvée chez l’homme ou l’animal infecté et correspond à un LPS complet. La phase II est une phase artificielle obtenue après plusieurs passages en cultures cellulaires in vitro. Cette phase est peu virulente et correspond à un LPS tronqué.
3 - Epidémiologie
| La fièvre Q est une zoonose de répartition mondiale, dont la prévalence est souvent sous-estimée du fait que, le plus souvent, elle n’est pas incluse dans la liste des maladies à déclaration obligatoire. Le réservoir animal est très étendu, mais l’homme s’infecte habituellement à partir d’animaux d’élevage (ovins, caprins, bovins), ou plus rarement d’animaux familiers (chat en particulier). De ce fait, les éleveurs, les vétérinaires, les personnels des abattoirs sont exposés professionnellement à cette maladie. La contamination par voie aérienne au contact d’animaux infectés est la plus fréquente. Du fait de la grande résistance de C. burnetii dans le milieu extérieur, la contamination peut être indirecte. Plusieurs épidémies de fièvre Q ont été décrites dans certaines vallées des Alpes, suite au passage de troupeaux de moutons infectés, dans le cadre de la transhumance. |
 |
C. burnetii est excrétée dans le lait des animaux infectés et la contamination humaine est possible à partir de produits laitiers ou dérivés non ou mal pasteurisés . Enfin, le placenta des femelles infectées ou leurs produits d’avortement contiennent une grande quantité de germes. La notion de contact avec une femelle parturiente au moment de la mise-bas est un facteur de risque majeur à rechercher devant toute personne suspecte de fièvre Q. Autrefois maladie essentiellement rurale, cette affection est de plus en plus souvent diagnostiquée en milieu urbain après contamination au cours de séjours en zone rurale.
L’investigation sérologique de populations au cours d’épidémies de fièvre Q a montré que plus de la moitié des patients infectés par C. burnetii demeurent asymptomatiques ou présentent une symptomatologie fugace (fièvre) spontanément résolutive. Parmi les patients symptomatiques, l’incubation moyenne est de 2 à 3 semaines, et la maladie aiguë se manifeste essentiellement sous trois formes cliniques :
| . un syndrome pseudo-grippal (fièvre, céphalées, arthralgies, myalgies) plus évocateur lorsqu’il survient au printemps ou en été (" grippe d’été ") . une pneumonie atypique . une hépatite biologique (élévation des transaminases). Une thrombopénie est souvent présente. Ces symptômes cliniques, biologiques et radiologiques sont souvent associés. |
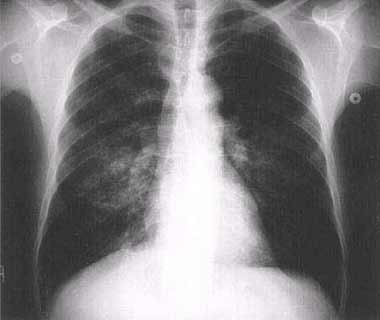 |
Environ 2% des patients infectés présentent une atteinte clinique sévère, nécessitant une hospitalisation. Parmi ces patients, les formes les plus sévères correspondent à des myocardites ou à des encéphalites. Environ 0,2% des patients infectés développent une fièvre Q chronique, qui se manifeste le plus souvent par une endocardite. Ces formes chroniques font toute la gravité de la maladie. Elles surviennent avec prédilection chez le patient immunodéprimé ou chez le patient présentant des lésions valvulaires cardiaques préalables ou porteur de prothèses valvulaires. La fièvre Q chez la femme enceinte peut être responsable d’avortements, d’accouchements prématurés et d’infection fœtale. Elle évolue souvent sur un mode chronique pendant la grossesse et éventuellement après accouchement. Du fait de la possibilité d’infection utérine persistante chez la femme, C. burnetii peut être responsable d’avortements à répétition.
5 - Diagnostic biologique
|
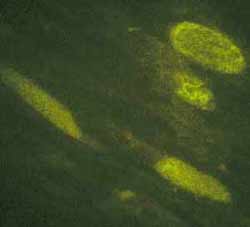
- Le diagnostic de fièvre Q repose sur la sérologie de type immunofluorescence indirecte (IFI). L’utilisation d’antigènes en phase I et II est utile pour différencier infections aiguës et chroniques. Les anticorps recherchés sont de type IgM et IgG et apparaissent 3 à 4 semaines après l'infection par C. burnetii. En pratique, un screening de tous les patients se fait par la recherche d'anticorps anti-phase II en 1ère intention Vacuoles cellulaires avec C. burnetii révélées par IFI |
 |
|
Détection de titres élevés d’anticorps
|
Maladie
|
|
anti-Phase II
|
infection récente ou aigue par cette espèce
|
|
anti-Phase I + anti-Phase II
|
évolution chronique de la maladie.
|
 |
- Les techniques d’amplification génique (PCR) appliquées directement aux prélèvements biologiques peuvent être utiles occasionnellement. Elles permettent par exemple de confirmer un diagnostic d’endocardite à hémoculture négative en montrant la présence d’ADN de cette espèce au niveau des valves cardiaques (exérèse chirurgicale). - L’isolement en cultures de cellules d'eucaryotes est effectué en laboratoire de référence, essentiellement pour établir une collection de souches. Sa sensibilité très faible limite grandement son intérêt diagnostique. |
Il existe un Centre National de Référence (CNR) en France: http://ifr48.free.fr/recherche/labo/rickettsies/rickettsies.html
6 - Sensibilité aux antibiotiques
L’évaluation de cette sensibilité ne peut être réalisée qu’en cultures cellulaires, généralement en laboratoire de référence, et ne se fait pas en routine.
- Les ß-lactamines et les aminoglycosides sont classiquement inactifs.
Seuls les antibiotiques à bonne pénétration et ayant une bonne activité à l’intérieur des cellules eucaryotes sont actifs: tétracyclines, fluoroquinolones, rifampicine et co-trimoxazole. L’activité des macrolides est variable d’une souche à l’autre. Aucune résistance acquise à ces antibiotiques n’a été caractérisée à ce jour en situation clinique.
Si le traitement de la fièvre Q aigue est bien établi, et repose essentiellement sur l'administration d'une tétracycline ou d'une fluoroquinolone, celui des formes chroniques demeure problématique et mal défini.
7- Prophylaxie
- Plusieurs vaccins ont été testés chez l’animal, sans succès évident ni sur la transmission inter-animale de C. burnetii, ni chez les animaux déjà infectés, sur l’excrétion chronique des bactéries. Certains vaccins ont même été associés à un risque accru de portage chronique de C. burnetii.
|
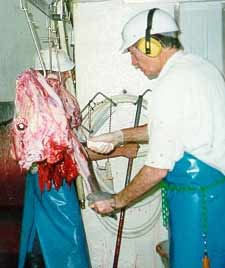
- Les antibiotiques ne permettent pas d’éradiquer C. burnetii chez les animaux infectés de façon chronique. De ce fait, la seule prophylaxie envisageable pour prévenir l’extension de l’infection chez les animaux d’élevage, est le dépistage systématique par la sérologie des animaux infectés et leur abattage. Ces mesures vétérinaires ne sont pas de pratique courante concernant la fièvre Q. - La prophylaxie de la fièvre Q chez l’homme correspond essentiellement à la pasteurisation des produits laitiers et dérivés d’une part, et à prévenir une contamination lors de contacts directs avec les animaux, en particulier au moment de la mise-bas. Il existe un vaccin efficace chez l’homme (Q-Vax) élaboré en Australie et non disponible en dehors de ce pays. Ce vaccin est préconisé dans ce pays chez les personnes à risque élevé d’exposition, tels que les travailleurs des abattoirs, par ailleurs protégés par des tenues adéquates. |
 |
Ce cours a été préparé par le Professeur M. MAURIN (Faculté de Médecine de Grenoble)(01.11.03).
http://www.cdc.gov/ncidod/dvrd/qfever/
http://www.med.sc.edu:85/mayer/ricketsia.htm
http://www.pbs.org/wgbh/nova/bioterror/agen_qfever.html
http://www.eurosurv.org/2002/020911.html
http://www.millennium-ark.net/News_Files/NBC/Bio.Bugs.Q.html
http://gsbs.utmb.edu/microbook/ch038.htm
http://wdhfs.state.wy.us/vector_borne/qfever.htm
http://www.health.qld.gov.au/HealthyLiving/Communicable_Diseases_P.htm
|
|
|
|
|
